|
|
|
|
|
|
|
3 |
8,52 |
7,52 |
0,88 |
-1,0·10-3 |
|
3,5 |
2,48·10 |
2,38 |
0,96 |
-3,16·10-4 |
|
4 |
4,62·10 |
7,5 |
0,99 |
-1,0·10-4 |
|
4,5 |
2,4·102 |
2,4·102 |
1,0 |
-3,16·10-5 |
|
5 |
7,59·102 |
7,6·102 |
1,0 |
-1,0·10-5 |
|
5,5 |
2,43·103 |
2,47·103 |
1,02 |
-3,16·10-5 |
|
6 |
8·103 |
8,46·103 |
1,06 |
-9,9·10-7 |
|
6,5 |
2,85·104 |
3,32·104 |
1,17 |
-2,84·10-7 |
|
7 |
1,21·105 |
1,7·105 |
1,39 |
0,01·10-7 |
|
7,5 |
7,06·105 |
1,17·106 |
1,66 |
2,88·10-7 |
|
8 |
5,43·106 |
1,01·107 |
1,86 |
1,0·10-6 |
|
8,5 |
4,92·107 |
9,61·107 |
1,96 |
3,2·10-6 |
|
9 |
4,76·108 |
9,46·108 |
1,99 |
1,01·10-5 |
|
9,5 |
4,73·109 |
9,46·109 |
2,0 |
3,2·10-5 |
|
10 |
4,77·1010 |
9,62·1010 |
2,01 |
1,01·10-4 |
|
10,5 |
4,95·1011 |
1,02·1012 |
2,06 |
3,2·10-4 |
|
11 |
5,52·1012 |
1,19·1013 |
2,16 |
1,01·10-3 |
|
11,5 |
7,35·1013 |
1,74·1014 |
2,37 |
3,2·10-3 |
|
12 |
1,31·1015 |
3,47·1015 |
2,65 |
1,01·10-2 |
|
12,5 |
3,14·1016 |
8,9·1016 |
2,85 |
3,2·10-2 |
При этом ![]() =1,002 ;
=1,002 ;![]() =-2,29·10-5.
Следовательно,
=-2,29·10-5.
Следовательно, ![]() =1,145·10-2 моль/кг
или 1,145·10-2·120·103=1375 мг/кг. Минимальная
концентрация NaH2PO4
будет
=1,145·10-2 моль/кг
или 1,145·10-2·120·103=1375 мг/кг. Минимальная
концентрация NaH2PO4
будет
иметь место при рН<6,95,
для которого по уравнению (4-7) ![]() = -9,4∙10-9 и
по таблице 4.1
= -9,4∙10-9 и
по таблице 4.1 ![]() =1,346, тогда
=1,346, тогда ![]() =2,72∙10-9 моль/кг или 0,33
мкг/кг.Таким образом, во всём диапазоне концентраций растворы мононатрийфосфата
имеют кислую реакцию.
=2,72∙10-9 моль/кг или 0,33
мкг/кг.Таким образом, во всём диапазоне концентраций растворы мононатрийфосфата
имеют кислую реакцию.
Для растворов
динатрийфосфата выражение (4-8) примет вид: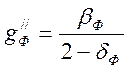 .
.
Знаменатель этой дроби положителен вплоть до рН≈9,5 (таблица 4.1). Числитель положителен в пределах от 7,1 до 9,4. Минимальная концентрация этой соли (примерно 15 мкг/кг) будет при рН= 7,1, а максимальная (примерно 1960 мг/кг) при рН= 9,4.
Переходя к растворам
тринатрийфосфата, следует в уравнение (4-8) подставить ![]() ,
тогда
,
тогда 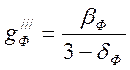 .
.
Из данных таблицы 4.1
можно видеть, что ![]() положителен при всех значениях
рН>7. Это означает, что растворы Na3PO4 могут иметь рН от 7 до 14 в зависимости от
концентрации. Все эти расчёты проведены при
положителен при всех значениях
рН>7. Это означает, что растворы Na3PO4 могут иметь рН от 7 до 14 в зависимости от
концентрации. Все эти расчёты проведены при ![]() , что
при небольших концентрациях фосфатов недопустимо. При высоких концентрациях и
точных расчётах следует учитывать реальные значения коэффициентов активности.
, что
при небольших концентрациях фосфатов недопустимо. При высоких концентрациях и
точных расчётах следует учитывать реальные значения коэффициентов активности.
Выражение (4-8) можно
использовать и для определения рН растворов Н3РО4, для
чего следует принять ![]() , тогда
, тогда ![]() .
.
Область положительных
значений ![]() охватывает рН≤ 6,9. С увеличением
охватывает рН≤ 6,9. С увеличением ![]() рН уменьшается.
рН уменьшается.
5. Растворимость труднорастворимых веществ
Растворимость естественных примесей в воде имеет большое значение для организации безнакипного водного режима, как для основного пароводяного цикла теплоэнергетической установки, так и для охлаждающей воды конденсаторов и сетевой воды теплофикационной системы.
Все натриевые соединения относятся к числу веществ, обладающих высокой растворимостью в воде, называемых поэтому легкорастворимыми. Кроме того, они относятся к типу соединений с положительным температурным коэффициентом растворимости, т.е. их растворимость с ростом температуры увеличивается. В связи с этим при организации водного режима поведение натриевых соединений по тракту обычно не рассматривают, а редко встречающееся участие натрия в отложениях бывает связано только с гидродинамическими нарушениями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.