![]() =
=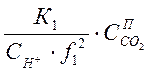 ;
(1-4)
;
(1-4)
![]() =
=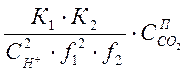 ;
(1-5)
;
(1-5)
где
f1 и
f2 -
коэффициенты активности соответственно одновалентного (![]() ) и двухвалентного (
) и двухвалентного (![]() ) ионов.
) ионов.
Общее количество СО2 , моль/кг, определяется суммой :
![]()
![]() =
=![]() +
+![]() +
+![]() ,
(1-6)
,
(1-6)
или после подстановки значений последующих двух слагаемых из уравнений (1-4) и (1-5) получим:
![]() =
=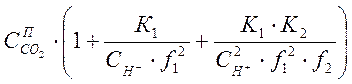 =
=![]() , (1-7)
, (1-7)
где
![]() =
= 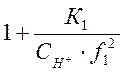
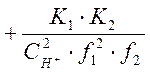 (1-8)
(1-8)
По условию электронейтральности раствора
![]() =
=![]() ,
,
так
как в системе СО2+Н2О из катионов присутствуют только Н+.
Произведя подстановку значений ![]() и
и ![]() из уравнений (1-4) и (1-5) и учитывая,
что
из уравнений (1-4) и (1-5) и учитывая,
что 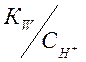 =
=![]() , получим (некоторые
значения
, получим (некоторые
значения ![]() приведены в таблице 1.2) :
приведены в таблице 1.2) :
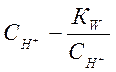 =
=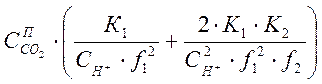 =
=![]() , (1-9)
, (1-9)
где
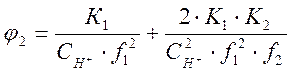 . (1-10)
. (1-10)
Из уравнения (1-7) найдём :
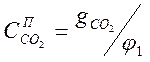 .
(1-11)
.
(1-11)
Подставив это значение в уравнения (1-4) и (1-5) , получим :
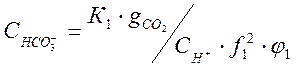 ; (1-12)
; (1-12)
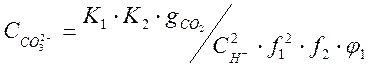 (1-13)
(1-13)
Эти равенства позволяют определить долю каждой из форм углекислоты, присутствующей в конденсате при данном значении рН.
Таблица 1.2 Ионное произведение воды
|
|
|
|
|
|
|
|
|
|
273 278 283 288 291 293 |
0,112 0,186 0,293 0,452 0,57 0,68 |
298 303 308 313 318 323 |
1,01 1,47 2,09 2,92 4,02 5,47 |
333 343 353 363 373 395 |
9,61 21,0 35,0 53,0 59,0 120 |
423 438 473 523 579 |
234 315 485 550 304 |
В двухфазной системе СО2-Н2О , если в газовой фазе кроме СО2 присутствуют только инертные газы, парциальное давление СО2 над жидкой фазой запишется следующим образом :
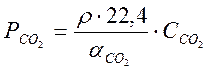 . (1-14)
. (1-14)
Значения
коэффициентов абсорбции ![]() для углекислоты
приведены в таблице 1.3
для углекислоты
приведены в таблице 1.3
Таблица 1.3 Константы Генри и коэффициенты абсорбции для углекислоты
|
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
60 |
|
|
737 |
890 |
1060 |
1240 |
1440 |
1650 |
1880 |
2120 |
2360 |
2600 |
2870 |
3450 |
|
|
1,17 |
1,42 |
1,19 |
1,02 |
0,88 |
0,76 |
0,66 |
0,59 |
0,53 |
0,48 |
0,44 |
0,36 |
Приближенное значение рН растворов углекислоты в воде,
зная её концентрацию, можно получить в ходе ряда преобразований. Исключив ![]() из уравнений (1-7) и (1-9) и приняв ряд
допущений, получим :
из уравнений (1-7) и (1-9) и приняв ряд
допущений, получим :
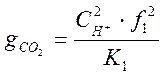 ,
моль/кг (1-15)
,
моль/кг (1-15)
или 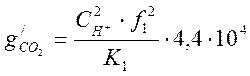 ,
мг/кг (1-16)
,
мг/кг (1-16)
Для разбавленных растворов, каким является конденсат, ![]() =1. Тогда из уравнения (1-16) получим:
=1. Тогда из уравнения (1-16) получим:
![]() (1-17)
(1-17)
При расчёте значений рН, вызванных присутствием каких-либо оснований, когда нельзя пренебречь присутствием ионных форм углекислоты (бикарбонатов и карбонатов), зависимости будут гораздо более сложными.
Ю. М. Кострикин при более точных расчётах значений рН растворов углекислоты предложил следующее, выведенное им уравнение [1]:
![]() .
.
![]() , (1-18)
, (1-18)
где
![]() - общее углеродсодержание раствора,
Моль/кг, т.е. сумма концентраций всех форм (производных) углекислот;
- общее углеродсодержание раствора,
Моль/кг, т.е. сумма концентраций всех форм (производных) углекислот; ![]() - ионное произведение воды.
- ионное произведение воды.
Вычисленные значения рН для различных концентраций углекислоты и температур приводятся в таблице 1.4.
Таблица 1.4 Значения
рН растворов угольной кислоты в зависимости от ![]()
и температуры
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.