Кальциевые и магниевые соединения относятся к числу труднорастворимых. Растворимость соединений кальция и магния зависит не только от температуры, но и от анионного состава воды. Из числа соединений кальция и магния такие соли, как CaCl2 и MgCl2 , обладают относительно высокой растворимостью в воде и имеют положительный температурный коэффициент растворимости. В связи с этим при определении анионного состава отложений в котлах редко приходится сталкиваться с наличием в них хлоридов (существуют лишь некоторые сложные соединения). Однако такие соли, как СаСО3 и СаSО4, имеют отрицательный температурный коэффициент растворимости, эта зависимость особенно ярко проявляется у СаSО4. При температурах более 300 0С растворимости СаSО4 и СаSО3 практически одинаковы, но при низких температурах они отличаются примерно на два порядка. Так, при 179 0С растворимость СаSО4 составляет 134 мг/кг, а при 100 0С она доходит до 670 мг/кг. Естественно поэтому ожидать в трубках конденсаторов отложений карбоната кальция, но не сульфата кальция [4].
При выпадении в осадок какого-либо труднорастворимого вещества с течением времени устанавлиается динамическое равновесие между осадком и раствором. Оно характеризуется постоянством концентрации этого вещества в растворе при данной температуре. Произведение активностей ионов труднорастворимого вещества также постоянно для данной температуре и называется произведением растворимостей ПР. Для бинарных электролитов КА оно будет определятся выражением
![]() , (5-1)
, (5-1)
где ![]() ,
,
![]() - активности ионов, г-ион/кг ;
- активности ионов, г-ион/кг ;![]() - коэффициент активности однозарядных
ионов ;
- коэффициент активности однозарядных
ионов ; ![]() ,
,![]() - концентрации ионов
г-ион/кг. Для бинарных веществ растворимость, моль/кг, равна концентрации
ионов, т.е.
- концентрации ионов
г-ион/кг. Для бинарных веществ растворимость, моль/кг, равна концентрации
ионов, т.е.
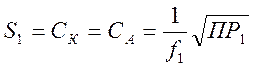 (5-2)
(5-2)
Для веществ типа К2А равенство (5-1) будет иметь вид :
![]() ,
(5-3)
,
(5-3)
где ![]() -
коэффициент активности для двузарядных ионов. Растворимость этого вещества
равна концентрации аниона :
-
коэффициент активности для двузарядных ионов. Растворимость этого вещества
равна концентрации аниона :
![]() ,
тогда
,
тогда ![]() и ,следовательно,
и ,следовательно, ![]() , или
, или 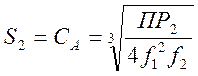 (5-4)
(5-4)
Эти же соотношения справедливы и для соединений типа КА2 , если в них катион и анион поменять местами.
Для соединений
типа К3А можем также написать :![]() и
и
![]() (5-5)
(5-5)
Отсюда 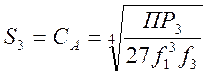 (5-6)
(5-6)
Для веществ типа КmAn
![]() (5-7)
(5-7)
В этом случае ![]() и
и ![]() ;
; ![]() .
.
Отсюда 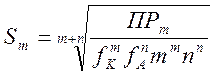 (5-8)
(5-8)
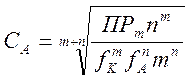 (5-9)
(5-9)
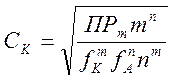 (5-10)
(5-10)
В разбавленных растворах, к числу которых относится вода теплоэнергетических установок (за исключением воды первого контура АЭС с ВВЭР и барабанных котлов), активности ионов могут быть заменены их концентрациями. Тогда условием предотвращения кальциевых отложений является соотношение
![]() <
< ![]()
Содержание Са в природных
водах обычно превалирует над содержанием Mg. Поэтому
при рассмотрении поведения труднорастворимых соединений обычно ограничиваются
кальциевыми соединениями. Как указывалось, анионами накипеобразователями
растворённых в воде солей могут быть SiO32-,
SO42-,CO32-.
Значения ПР для Са SiO3, Са SO4 и Са CO3 для
условий котловой воды при давлении в барабане 11,0 МПа (![]() =310 0С) составляют
10-10 – 10-8 (моль/кг)2. При наличии в воде
одновременно всех этих анионов растворимости соответствующих солей несколько
изменяются. Для качественного рассмотрения условий предотвращения отложений
кальциевых соединений принимают обычно, что
=310 0С) составляют
10-10 – 10-8 (моль/кг)2. При наличии в воде
одновременно всех этих анионов растворимости соответствующих солей несколько
изменяются. Для качественного рассмотрения условий предотвращения отложений
кальциевых соединений принимают обычно, что
![]() <
< ![]() (моль/кг)2
(5-11)
(моль/кг)2
(5-11)
Следовательно, зная значения ПР для разных температур, можно решить ряд вопросов по организации водного режима.
Примеры
5-1. Определить
карбонатную щёлочность известкованной воды, получающейся из исходной воды
следующего состава, мг-экв/кг: ЖСа=3,6; ЖMg=1,1;
Щ0=3,1; концентрация ионов, мг/кг: ![]() =105;
=105; ![]() =120;
=120; ![]() =69;
=69; ![]() =10. Расчёт следует вести для двух режимов
известкования (без коагуляции) – гидратного и карбонатного.
=10. Расчёт следует вести для двух режимов
известкования (без коагуляции) – гидратного и карбонатного.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.