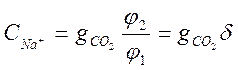 (2-3)
(2-3)
Как видим, ![]() является функцией
является функцией ![]() , т.е. рН. При
, т.е. рН. При ![]() →∞,
→∞, ![]() →0, если
→0, если ![]() →0,
→0, ![]() →2. Оба предела в действительности не
достигаются. В таблице 2.1 приведены численные значения
→2. Оба предела в действительности не
достигаются. В таблице 2.1 приведены численные значения ![]() ,
,
![]() ,
,![]() и
и ![]() в зависимости от рН, при условии
в зависимости от рН, при условии ![]() и
и ![]() =298 К.
=298 К.
В водоподготовке часто используются понятия «щёлочность по ФФ» (Щф) и «щёлочность по МО» (Щм), мг-экв/кг, для определения характера ионов щелочных соединений, присутствующих в воде или конденсате. Как известно, Щф и Щм определяется титрованием 0,1н. кислотой отобранной пробы до рН, при котором происходит смена окраски этих индикаторов (для ФФ при рН≈8,3, для МО при рН≈4).При рН<8,3 Щф≤0.
Если раствор (конденсат) является щелочным по ФФ (Щф>0), то при титровании его кислотой с фенолфталеином протекают следующие реакции:
![]()
![]() ,
,
т.е. с ФФ оттитровываются все гидраты и половина карбонатов. Тогда, мг-экв/кг:
![]() (2-4)
(2-4)
При титровании второй пробы того же раствора с МО, кроме приведённых двух реакций, добавится третья:
![]()
Следовательно, Щм, мг-экв/кг, равна:
![]() (2-5)
(2-5)
Общее количество СО2 (связанной), моль/кг, равно:
![]() (2-6)
(2-6)
Имея в виду, что ![]() , получим:
, получим:
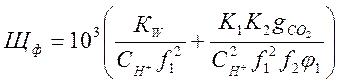 (2-7)
(2-7)
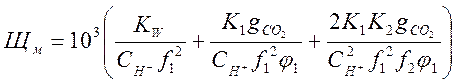 (2-8)
(2-8)
Стоящие в скобках выражения являются функциями рН [2]. Поэтому, решив совместно
уравнения (2-7) и (2-8) относительно ![]()
![]() ,
моль/кг, можно получить формулу для расчёта рН. Для этого примем (для
конденсата)
,
моль/кг, можно получить формулу для расчёта рН. Для этого примем (для
конденсата) ![]() , при Щф>0
, при Щф>0 ![]() =0, подставим численные значения
=0, подставим численные значения ![]() и получим:
и получим:
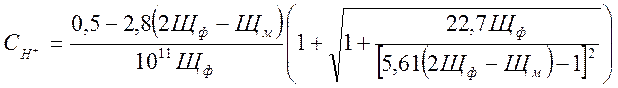
![]() (2-9)
(2-9)
2-1. Определить
![]() в конденсате, содержащем натрий в количестве
в конденсате, содержащем натрий в количестве ![]() =1 мг/кг и имеющем рН=5,5.
=1 мг/кг и имеющем рН=5,5.
Решение.
Из уравнения (2-2) определяем
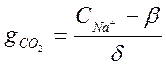 =
=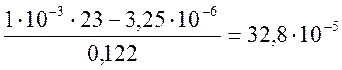 моль/кг; или 14,4 мг/кг. Из этого
количества СО2 4,35·10-5·44·103=1,9 мг/кг
находится практически в форме
моль/кг; или 14,4 мг/кг. Из этого
количества СО2 4,35·10-5·44·103=1,9 мг/кг
находится практически в форме ![]() и связана с натрием.
В конденсате, содержащем только СО2, рН=5,5 достигается растворением
всего 1 мг/кг СО2. Добавка же NаОН в количестве
1,74 мг/кг требует для достижения того же рН введения большего количества СО2.
и связана с натрием.
В конденсате, содержащем только СО2, рН=5,5 достигается растворением
всего 1 мг/кг СО2. Добавка же NаОН в количестве
1,74 мг/кг требует для достижения того же рН введения большего количества СО2.
2-2. Определить рН растворов бикарбоната натрия при температуре 298 К.
Решение.
Для растворения NaНСО3 имеет место соотношение:
![]() =
=![]() ,
,
так как в растворе будут присутствовать главным
образом ионы ![]() и
и ![]() . Тогда выражение (2-1) может быть написано
в таком виде:
. Тогда выражение (2-1) может быть написано
в таком виде:
![]() ,откуда
,откуда
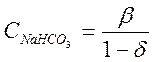 (2-10)
(2-10)
Равенство имеет физический смысл только при ![]() >0 и
>0 и ![]() <1.
Но
<1.
Но ![]() >0 возможно только при рН≥7,0 (таблица
2.1). Это – нижний предел рН для концентраций бикарбонатов. Верхний предел рН
определяется условием
>0 возможно только при рН≥7,0 (таблица
2.1). Это – нижний предел рН для концентраций бикарбонатов. Верхний предел рН
определяется условием ![]() =1,0,
что имеет место при рН=8,3. Пользуясь данными таблицы 2.1, можно также
определить промежуточные концентрации растворов бикарбонатов и их рН. По этой
таблице можно найти , что при конценрациях
=1,0,
что имеет место при рН=8,3. Пользуясь данными таблицы 2.1, можно также
определить промежуточные концентрации растворов бикарбонатов и их рН. По этой
таблице можно найти , что при конценрациях ![]() ≥0,7 мг-экв/л рН растворов остаётся
практически постоянным, близким к 8,3. Другими словами, бикарбонатом натрия
нельзя создавать рН раствора больше 8,3. Это можно сделать, использовав
взамен NaHCO3 кальцинированную
соду. В этом случае можно написать:
≥0,7 мг-экв/л рН растворов остаётся
практически постоянным, близким к 8,3. Другими словами, бикарбонатом натрия
нельзя создавать рН раствора больше 8,3. Это можно сделать, использовав
взамен NaHCO3 кальцинированную
соду. В этом случае можно написать:
![]() ,
,
поскольку молекула Na2CO3 содержит два грамма-иона натрия. Следовательно, уравнение (2-1) можно написать так:
![]() или
или 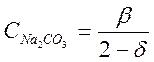 (2-11)
(2-11)
Для сохранения физического смысла в этом случае
необходимо, чтобы ![]() >0 и
>0 и ![]() <2.
По данным таблицы 2.1
<2.
По данным таблицы 2.1 ![]() >0 достигается при рН≥7, а
>0 достигается при рН≥7, а![]() <2 – при рН<12. Это означает, что
растворы Na2CO3
обладают рН в пределах 7-12 в зависимости от концентрации.
<2 – при рН<12. Это означает, что
растворы Na2CO3
обладают рН в пределах 7-12 в зависимости от концентрации.
2-3. Общее
количество (свободной и связанной) углекислоты в конденсате составляет ![]() , моль/л. Определить концентрацию СО2
, бикарбонатов и карбонатов при рН=9 и температуре 298 К.
, моль/л. Определить концентрацию СО2
, бикарбонатов и карбонатов при рН=9 и температуре 298 К.
Решение.
По уравнению (1-7) 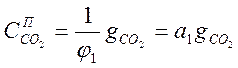
Подставив в (1-4) и (1-5) это значение СО2, получим:
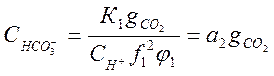 ;
; 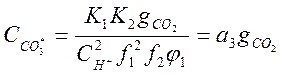 (2-12)
(2-12)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.