|
|
При температуре |
||||
|
5 0С |
10 0С |
20 0С |
50 0С |
100 0С |
|
|
0,004 0,044 0,22 0,44 0,88 2,2 4,4 8,8 22,0 44,0 88,0 |
7,06 6,382 5,984 5,827 5,677 5,488 5,351 5,220 5,053 4,932 4,814 |
- 6,361 5,959 5,801 5,651 5,463 5,327 5,169 5,030 4,910 4,792 |
- 6,372 5,924 5,766 5,615 5,427 5,292 5,162 4,997 4,877 4,761 |
- 6,251 5,879 5,723 5,574 5,387 5,252 5,123 4,960 4,841 4,725 |
- 6,044 5,816 5,683 5,545 5,365 5,232 5,104 4,942 4,824 4,708 |
Как видно из рисунка 1.1, влияние углекислоты на рН тем слабее, чем выше температура. При низких температурах даже ничтожные количества СО2 в конденсате приводят к резкому снижению рН.
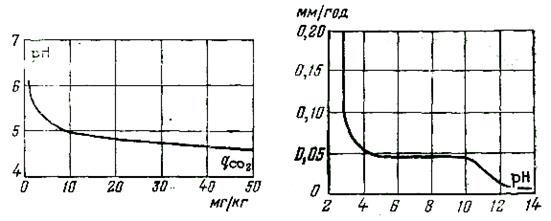
Рис. 1.1 Зависимость рН чистого Рис. 1.2 Скорость коррозии стали в
конденсата от количества раст- воде при различных рН при 295 К.
ворённой углекислоты.
Представляют большой интерес коэффициенты
распределения углекислоты [1]. Значения так называемого молекулярного
коэффициента распределения, представляющего отношение концентраций только
молекулярных (СО2 + Н2СО3) форм углекислоты в
паре и воде приведены на рисунке 1.3. Естественно, молекулярный коэффициент
распределения не является функцией рН ; он будет равен так называемому видимому
коэффициенту ![]() ,
представляющему собой соотношение
,
представляющему собой соотношение
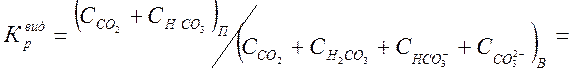
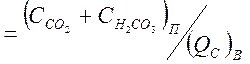 ,
(1-19)
,
(1-19)
лишь
в том случае, когда концентрация ионных форм ![]() в растворе будет близка к нулю, что имеет место к
кислотной области значений рН. Для случая , когда парциальное давление
в растворе будет близка к нулю, что имеет место к
кислотной области значений рН. Для случая , когда парциальное давление ![]() практически равно общему
практически равно общему ![]() , т.е.
, т.е. ![]() =1000 кг/м3 и
=1000 кг/м3 и ![]() <<
<<![]() ,выражение молекулярного коэффициента
распределения ещё упрощается :
,выражение молекулярного коэффициента
распределения ещё упрощается :
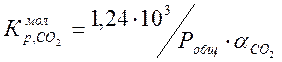 . (1-20)
. (1-20)
Все расчёты растворимости и коэффициентов распределения углекислоты между водой и паром значительно усложняются при одновременном наличии в растворе каких-нибудь компонентов основного характера, взаимодействующих с углекислотой, что, естественно, приводит к образованию ионных форм и повышению рН среды. Доля свободной (молекулярной) углекислоты в общем углеродсодержании воды всегда при этом будет функцией рН раствора, т.е.
![]() (1-21)
(1-21)
эта функция может быть выражена по-разному, в частности в виде
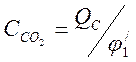 , (1-22)
, (1-22)
где
![]() (1-23)
(1-23)
Тогда видимый коэффициент распределения углекислоты может быть вычислен по уравнению
![]() (1-24)
(1-24)
или ![]() (1-25)
(1-25)
Таким
образом, ![]() определяется уравнением (1-24) как
коэффициент распределения, зависящий в отличие от
определяется уравнением (1-24) как
коэффициент распределения, зависящий в отличие от ![]() от рН
среды.
от рН
среды.
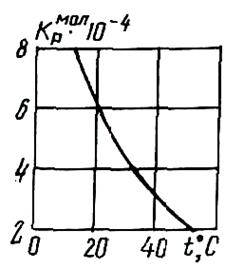
Рис. 1.3 Зависимость молекулярного коэффициента распределения
углекислоты от температуры
1-1. Определить рН 0,1 н. раствора НСl при 298 К.
Решение.
Принимаем ![]() ,
тогда
,
тогда ![]() г-ион/л и рН=- lg 10-1=1
.
г-ион/л и рН=- lg 10-1=1
.
Определим рН этого же раствора с учётом коэффициента
активности. Ионная сила раствора равна 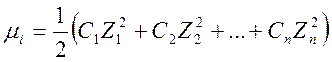 =0,1 ,
значение
=0,1 ,
значение ![]() = 0,78 (см. таблицу П1 Приложения),
тогда
= 0,78 (см. таблицу П1 Приложения),
тогда ![]() 0,078 г-ион/л.
0,078 г-ион/л.
рН= -lg ![]() = - lg
0,078 =1,11.
= - lg
0,078 =1,11.
1-2. Значение рН раствора Н2SO4 составляет 2,8. Найти молекулярную концентрацию раствора.
Решение.
![]()
![]() г-ион/л.
Так как для Н2SО4
г-ион/л.
Так как для Н2SО4 ![]() =2С, то
=2С, то ![]()
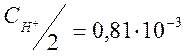 М.
М.
1-3. Определить рН конденсата, содержащего 1мг/кг СО2.
Решение.
Подставив в уравнение (1-17) ![]() =1
мг/кг, получим рН=5,5.
=1
мг/кг, получим рН=5,5.
1-4. Определить верхний предел допустимой концентрации СО2 в паре, не содержащем щелочных соединений, с точки зрения коррозионной агрессивности конденсата.
Решение.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.