Интересным является вопрос о механизме реакции этерификации, т.е. вопрос об образовании воды в этой реакции, а именно: за счет какого гидроксила – кислоты или спирта – образуется вода. Используя метод «меченых атомов» (в реакцию ввели спирт, который содержал тяжелый изотоп кислорода 18О), было установлено, что после этерификации «меченый» атом кислорода входил в состав сложного эфира, а вода содержала обычный атом кислорода:
|
На основе этого пришли к выводу, что вода при этерификации образуется за счет атома водорода OH-группы спирта и гидроксила –COOH группы кислоты. Таким образом, в реакции этерификации осуществляется нуклеофильное замещение OH-группы карбоксила кислоты на алкоксильную группу R`O-спирта. Но в связи с тем, что спирт является слабым нуклеофилом, а карбоновая кислота несильным электрофилом, то реакция взаимодействия карбоновой кислоты и спирта осуществляется достаточно медленно. С этой целью в реакционную смесь добавляют небольшое количество концентрированной H2SO4, или вводят газообразный HCl. Катализатором могут быть также и кислоты Льюиса, например BF3. Механизм реакции этерификации в присутствии каталитических количеств кислот можно представить в виде равновесных реакций:
 |
|||
 |
|||
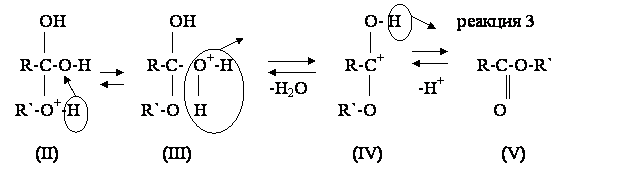
На медленной стадии (реакция 1) к карбонильному атому кислорода присоелиняется протон (катализатор) и образуется карбониевый ион (I), в котором значительно увеличивается положительный заряд на карбонильном атоме углерода. На второй стадии (реакция 2) катион (I) присоединяет молекулу спирта и образует связь между карбонильным атомом углерода и гидроксилом спирта за счет свободной пары электронов его атома кислорода. В результате образуется оксониевое соединение (II), которая потом перегруппировывается в гидроксониевое соединение (III), способное отщеплять воду и преобразовываться в карбкатион (IV). На последней стадии карбкатион (IV) отщепляет протон, который начинал каталитический процесс на первой стадии, и превращается (реакция 3) в конечный продукт этерификации – сложный эфир (V).
Сложные эфиры низших карбоновых кислот представляют собой жидкости с приятным запахом, легче воды.
1.6.3.Реакции с участием a-водородного атома
Карбоксильная группа, как говорилось выше, является электрофильной и проявляет отрицательный электронный эффект ((-)I-эффект), под влиянием которого электронная плотность на a-углеродном атоме алкильного радикала уменьшается.
Вследствие этого данный атом углерода сильнее притягивает к себе электронные пары от атомов водорода и тем самым повышает активность a-водородных атомов, которые становятся подвижными и могут принимать укчастие в реакциях замещения. Так, в молекуле уксусной кислоты a-водородные атомы могут последовательно замещаться на атомы галогена:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.