СОДЕРЖАНИЕ
|
Введение ………..…………………………………………………………………4 |
|
Лабораторная работа №1 часть 1………………………………………………..5 |
|
Лабораторная работа №1 часть 2………………………………………………10 |
|
Лабораторная работа №2 часть 1………………………………………………15 |
|
Лабораторная работа №2 часть 2………………………………………………19 |
|
Лабораторная работа №3 часть 1 ……………………………………………...24 |
|
Лабораторная работа №3 часть 2………………………………………………28 |
|
Лабораторная работа №3 часть 3………………………………………………33 |
|
Приложения……………………………………………………………………..38 |
|
Лабораторная работа №1 часть 1 Основные элементы……………………….39 |
|
«Мановакууметр»………………………………………………………….39 |
|
«Термометр»……………………………………………………………….44 |
|
«Концентратомер»…………………………………………………………47 |
|
Кнопка «Ok»………………………………………………………………50 |
|
Кнопка «Сброс»……………………………………………………...…...55 |
|
Таблица данных…………………………………………..………….…...56 |
|
Лабораторная работа №1 часть 2………………………………………………57 |
|
Лабораторная работа №2 часть 1………………………………………………60 |
|
Лабораторная работа №2 часть 2………………………………………………63 |
|
Лабораторная работа №3 часть 1 ……………………………………………...65 |
|
Лабораторная работа №3 часть 2………………………………………………67 |
|
Лабораторная работа №3 часть 3………………………………………………71 |
ВВЕДЕНИЕ
Одним этапов обучения студентов специальности “Основные процессы химических производств и химическая кибернетика” (ОПХП и ХК) является прохождение ими лабораторного практикума с целью закрепления теоретических основ курсов «Технология и оборудование отрасли», «Макрокинетика и расчет реакторов». В связи со сложностью изучаемых процессов, высокими температурами и давлениями, токсичными веществами создание лабораторных стендов не представляется возможным. Для целей практического изучения реальных технологических процессов созданы виртуальные лабораторные работы в основе которых лежат имитаторы рассматриваемых процессов и соответствующие математические модели.
Практикум содержит 7 лабораторных работ, сгруппированных по трем разделам: контактное окисление диоксида серы; конверсия оксида углерода в диоксид; синтез аммиака на железном катализаторе. В каждом разделе изучается термодинамика и кинетика процесса.
Пособие имеет характер практического руководства. Излагается необходимый теоретический материал, после чего приводятся варианты заданий, которые выполняют студенты, пользуясь соответствующим имитатором и пояснениями к нему. Результаты работ представляются в виде таблиц и обрабатываются в виде графических зависимостей, вид которых студенты должны объяснить на основании теории данного процесса и сделать соответствующие выводы. Приводятся основные вопросы на коллоквиум.
ЛАБОРАТОРНАЯ РАБОТА № 1
Исследование равновесия и кинетики реакции контактного окисления SO2 в SO3 в производстве серной кислоты
Часть первая. Исследование равновесия
Теоретическое введение
По объему промышленного производства серная кислота занимает одно из первых мест среди продуктов, производимых химической промышленностью.
В основе всех технологических схем производства серной кислоты лежит обратимая реакция окисления диоксида серы в триоксид кислородом воздуха:
SO2 + 0,5O2 = SO3 + Q (1.1)
Зависимость теплового эффекта реакции от температуры (кДж/кмоль) выражается уравнением:
Q = 92323,7 + 23,359Т - 43,8902∙10-3Т2 + 26,905∙10-6Т3 – 6,905∙10-9Т4 (1.2)
В интервале температур 400÷700 оС можно пользоваться упрощенным уравнением:
Q = 101419 - 9,26Т (кДж/кмоль) (1.3)
Согласно принципа Ле-Шателье, равновесие реакции (1) сдвигается в сторону продуктов реакции при понижении температуры и повышении давления. И то и другое в ощутимых пределах трудно осуществимо, так как при температурах ниже 400 0С скорость реакции мала даже в присутствии катализаторов, а повышение давления, которое вызвало бы видимый эффект, сопряжено со значительными техническими трудностями.
На практике реакцию окисления SO2 в SO3 проводят при атмосферном давлении и температурах 400÷650 оС.
Константа скорости реакции, выраженная через парциальные давления компонентов, определяется из уравнения:
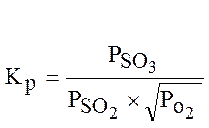 (1.4.)
(1.4.)
Равновесная степень превращения сернистого газа в серный ангидрид:
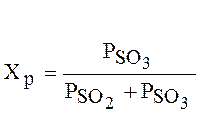 (1.5)
(1.5)
Из уравнения константы равновесия следует, что:
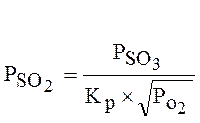 (1.6)
(1.6)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.