1. По уравнению (1.19.) вычислить оптимальные температуры при различных степенях превращения и на графике ХР = f(t) построить линию оптимальных температур (ЛОТ) для вашего варианта.
Оптимальная температура для каждой степени контактирования
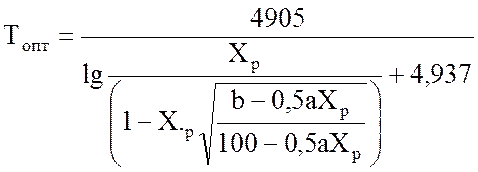
2. Учитывая зависимость температуры газа от степени окисления SO2 (1.20), используя кривую ЛОТ построить диаграмму X – t адибатного процесса контактирования для вашего варианта работы.
t = tн + λ(X - XH), (1.20)
где t – температура газа в на выходе из слоя катализатора, tн – температура газа на входе в слой катализатора, (X - XH) - степень контактирования (для I слоя tн = 380÷420 оС, XH = 0); λ – повышение температуры газа на 1% контактирования.
Величина λ зависит от начального содержания SO2 в газовой смеси.
|
Содержание SO2, % |
λ, град. |
Содержание SO2, % |
λ, град. |
Содержание SO2, % |
λ, град. |
|
2 |
60 |
7 |
200 |
9,5 |
265 |
|
3 |
89 |
7,5 |
213 |
10 |
278 |
|
4 |
117 |
8 |
226 |
11 |
303 |
|
5 |
145 |
8,5 |
239 |
12 |
328 |
|
6 |
173 |
9 |
252 |
14 |
378 |
Определить, сколько слоев катализатора необходимо для достижении степени превращения 95% ? 99,95% ?
3.В чем сущность двойного контактирования ? Как рассчитать степень окисления SO2 при двойном контактировании?
4. Почему зависимость скорости от температуры имеет экстремум?
5. Как рассчитать объем катализатора при проведении процесса окисления SO2 в изотермических условиях? Какую конструкцию изотермического реактора для проведения данного процесса вы можете предложить?
6. Как рассчитать объем катализатора при проведении процесса окисления SO2 в адиабатических условиях? Почему на практике данный процесс проводят, разбивая объем катализатора на отдельные слои, между которыми газ охлаждают.
7. Почему избыток кислорода позволяет повысить степень превращения SO2
8. Какие компоненты входят в состав катализатора для окисления SO2
9. Как влияет пористая структура и поверхность катализатора на его активность.
ЛИТЕРАТУРА
1. Справочник сернокислотчика
2. Васильев Б.Т. Отвагина М.И. Технология серной кислоты.-М.:Химия, 1985.-384 с.
3. Широков Ю.Г, Смирнов Н.Н, Прокофьев В.Ю. Теоретические основы технологии неорганических веществ: Сборник лабораторных работ с применением ЭВМ / Ив. гос. хим.-техн. ун-т; Иваново,1999.-116 с.
ЛАБОРАТОРНАЯ РАБОТА № 2
Исследование равновесия и кинетики реакции конверсии оксида углерода с водяным паром
Часть первая. Исследование равновесия
Теоретическое введение
Химическая реакция взаимодействия оксида углерода с водяным паром широко используется в промышленных масштабах. Этот метод получения водорода стал одним из основных. Переработке в водород подвергают газ после конверсии метана, однако, для этой цели можно использовать любые газы, содержащие СО, в том числе полученные газификацией каменного угля.
СО + Н2О = СО2 + Н2 + 41,17 кДж (2.1.)
Реакция (2.1.) обратима. Согласно принципа Ле-Шателье, равновесие реакции сдвигается в сторону продуктов реакции при понижении температуры. Давление на равновесие не влияет, однако его повышение позволяет уменьшить габариты реакционных аппаратов и тем самым играет положительную роль. До давления 5 МПа для расчета равновесных содержаний компонентов могут быть использованы значения их парциальных давлений или концентраций.
Равновесное содержание оксида углерода в конвертированном газе рассчитывают по значению константы равновесия реакции:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.