Как показано в первой части работы степень превращения азота и водорода в аммиак увеличивается с увеличением температуры и повышением давления. Но даже при температурах около 400 оС в отсутствии катализатора скорость реакции ничтожно мала. В промышленных условиях данный процесс проводят при температурах 400÷600 оС и давлении около 300 МПа. В качестве катализатора используют железный катализатор марки СА, промотированный оксидами алюминия, калия и кальция.
Как следует из первой части работы, даже при высоких давлениях степень превращения азота и водорода в аммиак невелика. Именно по этой причине промышленное производство аммиака организовано по замкнутому циклу, что приводит к накоплению инертных примесей в циркулирующем газе и необходимости постоянного удаления части этого газа (непрерывная продувка).
Кинетика реакции синтеза аммиака тесно связана с термодинамикой процесса. На скорость образования аммиака помимо температуры и давления влияют соотношение азота и водорода в газе, концентрация аммиака и содержание инертов в нем, а также ряд других факторов.
Поскольку реакция синтеза аммиака является обратимой, то общая скорость реакции rбудет складываться из скорости прямой r1 и обратной r2 скоростей:
r = r1 + r2 (3.10.)
Скорость синтеза аммиака на большинстве катализаторов описывается уравнением Темкина – Пыжова:
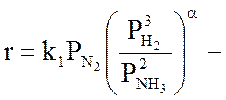
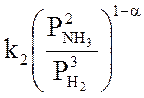 , (3.11.)
, (3.11.)
где
r – наблюдаемая
скорость реакции; k1, k2
– константы скорости образования и разложения аммиака, отношение которых равно
константе равновесия: k1/k2
=К; ![]() - парциальные давления аммиака,
азота и водорода в газовой смеси; α – постоянная, лежащая в интервале 0<α<1.
- парциальные давления аммиака,
азота и водорода в газовой смеси; α – постоянная, лежащая в интервале 0<α<1.
Значение α характеризует степень покрытия поверхности катализатора азотом в условиях синтеза аммиака. Для промышленных катализаторов эта величина в интервале температур 400÷600 оС может быть принята равной 0,5.
В этом случае уравнение (3.11) примет вид:
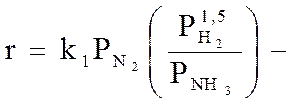
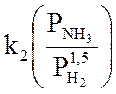 (3.12)
(3.12)
Для расчета скорости реакции удобно уравнение (3.1) представить в виде:
Кр
=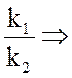 k1 = k2КР
(3.13)
k1 = k2КР
(3.13)
КР
=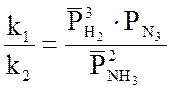 (3.14)
(3.14)
![]()
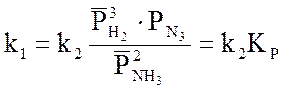
![]() (3.15)
(3.15)
Константу скорости k2 рассчитываем из уравнения Аррениуса:
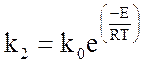 (3.16)
(3.16)
Для железных катализаторов синтеза аммиака: k0=3,655∙10-17 Па0,5/с; Е=158 кДж/моль.
С учетом выше изложенного, уравнение для скорости реакции можно записать:
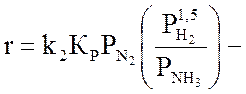
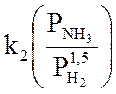 (3.17)
(3.17)
Константу равновесия КР в зависимости от температуры рассчитываем из эмпирического уравнения (3.8).
Парциальные давления компонентов в момент протекания реакции определим, с учетом наличия в газе инертных примесей, из выражений:
![]()
![]()
![]()
![]() (3.18)
(3.18)
где
![]() равновесные концентрации аммиака, азота,
водорода, и инертов, выраженные с мольных долях ; Р – давление смеси.
равновесные концентрации аммиака, азота,
водорода, и инертов, выраженные с мольных долях ; Р – давление смеси.
Для расчета концентраций компонентов примем, что на один моль азота в исходной смеси находятся U моль водорода, где U мольное соотношение Н2:N2, и i моль инертов. В момент равновесия образуется z моль аммиака, содержание инертов не изменяется.
Расчет состава реакционной газовой смеси приведен в таблице 3.4.
Таблица 3.4.
Расчет состава равновесной газовой смеси.
|
Компонент |
Исходная смесь |
Реакционная смесь |
|
|
начальное число молей |
число молей |
мольная доля |
|
|
азот |
1 |
1-0,5z |
|
|
водород |
U |
U-1,5z |
|
|
аммиак |
0 |
z |
|
|
инерты |
i |
i |
|
|
сумма |
1+ U +i |
1+U - z + i |
ΣCi =1 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.