Примечание: ![]() ,
, ![]() ,
, ![]() и
и ![]() - равновесные концентрации компонентов
газовой смеси. ХР –равновесная
степень превращения SО2 в SО3.
- равновесные концентрации компонентов
газовой смеси. ХР –равновесная
степень превращения SО2 в SО3.
На основании данных, представленных в таблице 1.2. строятся графические зависимости:
- степени превращения SО2 в SО3 от температуры Хр = f(t) при постоянном давлении;
- степени превращения SО2 в SО3 от давления Хр = f(Р); при постоянных температурах (выбрать 3 температуры);
- степени превращения SО2 в SО3 в зависимости от концентрации кислорода в исходном газе;
- степени превращения SО2 в SО3 в зависимости от концентрации диоксида серы в исходном газе.
По полученным результатам работы делаем выводы к первой части работы.
Часть 2. Исследование кинетики каталитического окисления SО2
Теоретическое введение
Производительность контактного аппарата для окисления диоксида серы помимо химического равновесия определяется кинетикой процесса. Объем катализатора, необходимый для обеспечения заданной производительности контактного аппарата вычисляется по формуле:
![]() ,
(1.13)
,
(1.13)
где Vкат – необходимый объем контактной массы, м3; v0 – объемная скорость исходной реакционной смеси, приведенная к нормальным физическим условиям, м3/с; τ – условное время контакта реакционной смеси и катализатора, с.
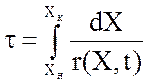 ,
(1.14)
,
(1.14)
где Хн и Хк – начальная и конечная степень превращения SО2 в SО3; r(X,t) – скорость химической реакции, определяемая кинетическим уравнением для данного процесса.
Процесс окисления двуокиси серы на зернах катализаторов, используемых в промышленных контактных аппаратах, протекает в переходной области (между областями химической кинетики и внутренней диффузии). Процессы переноса к внешней поверхности зерен катализатора оказывают влияние на скорость окисления SО2 лишь при высеких температурах, малых степенях превращения и высоком содержании двуокиси серы. При переработке газа, содержащего менее 10% об. SО2, влияние внешней диффузии можно не учитывать.
Степень использования внутренней поверхности катализатора зависит от пористости его структуры, крупности зерен и степени превращения.
Предложено несколько кинетических уравнений, описывающих зависимость скорости реакции окисления SО2 на ванадиевых катализаторах от состава газовой смеси и температуры. Более точно эта зависимость описывается уравнением Борескова-Иванова
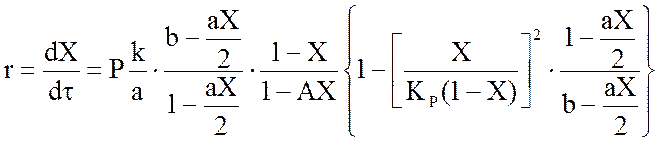 , (1.15)
, (1.15)
где X – достигаемая степень превращения, д. ед; Р – давление, ат; «а» и «b» объемные доли диоксида серы и кислорода в смесим на входе; k – константа скорости реакции, с-1ат; КР – константа равновесия, ат-0,5.
Если давление выражать в Па, уравнение (1.15) примет вид:
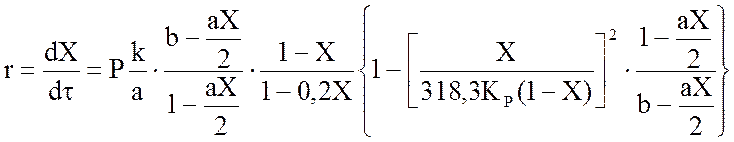 , (1.16)
, (1.16)
где Р – давление в Па; 318,3 – коэффициент пересчета константы равновесия.
Константа равновесия в уравнении (1.16) может быть рассчитана по формуле:
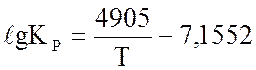 →
→ 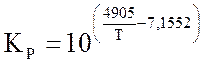 Па-0,5
(1.17)
Па-0,5
(1.17)
Константа скорости рассчитывается по уравнению Аррениуса:
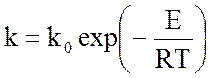 ,
(1.18)
,
(1.18)
где k0 и E соответственно предэкспоненциальный множитель и энергия активации, их значения для некоторых катализаторов приведены а таблице 1.3.
Таблица 1.3.
Значение предэкспоненциального множителя и энергии активации для ряда катализаторов окисления SO2 в SO3
|
Тип катализатора |
Энергия активации, Е, Дж/моль |
Предэкспонента, k0, Па∙с-1 |
|
СВД |
64000 |
96500 |
|
ИК-1-6. |
61000 |
113000 |
|
Монтеканто LP-120 |
53240 |
13800 |
|
Монтеканто LP-110 |
52000 |
11500 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.