Аналогично для других соотношений пар:газ
Такой же вид будут иметь таблицы для вариантов 2 и 3. Для вариантов 5,6,7 значения температур выносятся в заголовок таблицы, а в графу 1 заносится соотношение пар:газ в исходной смеси. В варианте 4 в заголовок таблиц выносится исходный состав сухого газа остальное, как в вариантах 1-3.
На основании данных таблицы 2.2. строятся графические зависимости:
- равновесной степени превращения СО от температуры Хр = f(t) при 3-х постоянных отношенях пар:газ и заданном составе исходной газовой смеси;
- равновесной степени превращения СО от соотношения пар:газ Хр = f(n0); при постоянных температурах (выбрать 3 температуры);
-равновесной степени превращения СО в зависимости от концентрации этого компонента в исходном газе при постоянной температуре (выбрать 3 значения температуры) и соотношении пар:газ;
-равновесной степени превращения СО в зависимости от температуры при различных содержаниях СО и постоянном значении пар:газ в исходном газе;
- зависимость константы скорости от температуры.
При недостатке опытных данных для построения графиков взять их у товарищей по группе, выполняющих другие варианты.
По полученным результатам делаем выводы к первой части работы.
Часть 2. Исследование кинетики реакции конверсии СО водяным паром.
Теоретическое введение
Скорость реакции конверсии СО водяным паром при протекании в гомогенных условиях незначительна, поэтому данный процесс проводят в гетерогенных условиях, используя катализаторы. На ускорение этого процесса влияют оксиды железа, хрома, кобальта, никеля, меди. Все катализаторы конверсии СО можно разделить на 2 группы: среднетемпературные и низкотемпературные. Основу первых составляют оксиды железа и хрома. С достаточной скоростью среднетемпературные катализаторы работают при температурах 430-470 оС. По условиям равновесия реакции конверсии, степень превращения СО в Н2 в указанном температурном интервале недостаточна, так как остаточное содержание оксида углерода в газе составляет 3-6 % об, поэтому необходимы вторая ступень конверсии, которую осуществляют при 180 - 250 оС. При этих условиях и избытке водяного пара остаточная концентрация СО в конвертированном газе около 0,3 % об., и очистка газа перед синтезом аммиака от этой примеси значительно упрощается. Основу низко-температурных катализаторов составляют оксиды цинка, хрома и меди. Их недостатком является повышенная чувствительность к каталитическим ядам и перегреву.
Кинетика реакции конверсии оксида углерода на средне- и низкотемпературных катализаторах описывается уравнением:
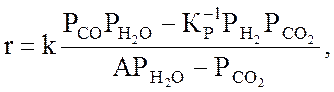 (2.15)
(2.15)
где
r – скорость реакции; k – константа
скорости, 1/(с∙ат); КР – константа равновесия; А – постоянная величина;
![]() ,
, ![]()
![]()
![]() - парциальные
давления компонентов, ат. За скорость реакции принят объем СО, вступающего в
реакцию за 1 секунду на единицу объема катализатора.
- парциальные
давления компонентов, ат. За скорость реакции принят объем СО, вступающего в
реакцию за 1 секунду на единицу объема катализатора.
Для железохромовых катализаторов в интервале температур 400-500 оС имеем:
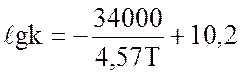 (2.16)
(2.16)
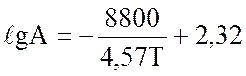 (2.17)
(2.17)
Для катализаторов НТК-4 и НТК-8:
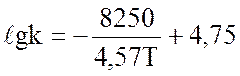 (2.18)
(2.18)
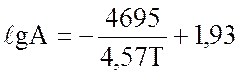 (2.19)
(2.19)
Константа равновесия рассчитывается по уравнению (2.9)
Таблица 2.3.
Варианты заданий к лабораторной работе 2 (часть II)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.