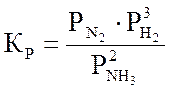 ,
(3.2)
,
(3.2)
где
КР- константа равновесия реакции; ![]() -
парциальные давления аммиака, азота и водорода в равновесной смеси.
-
парциальные давления аммиака, азота и водорода в равновесной смеси.
Парциальные
давления можно выразить через давление смеси и объемную концентрацию
компонента. Обозначив, соответственно, ![]() равновесные
концентрации аммиака, азота и водорода, об. %, и Р – давление смеси. В этом
случае:
равновесные
концентрации аммиака, азота и водорода, об. %, и Р – давление смеси. В этом
случае:
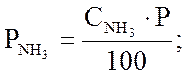
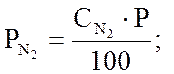
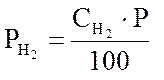 (3.3)
(3.3)
уравнение (3.2) примет вид:
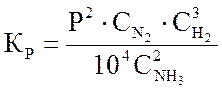 (3.4)
(3.4)
Для решения уравнения (3.4) воспользуемся дополнительными уравнениями:
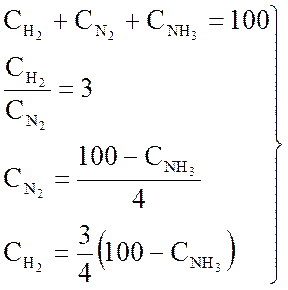 (3.5)
(3.5)
Подставив последние выражения в уравнение (3.4) получим уравнение равновесия
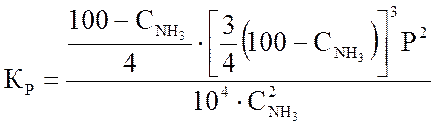 (3.6)
(3.6)
Проведя преобразования, получим квадратное уравнение
![]()
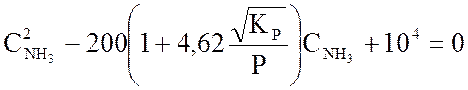 (3.7)
(3.7)
Константу равновесия вычисляем из эмпирического уравнения А.Т. Ларсона и Р.Л. Доджа
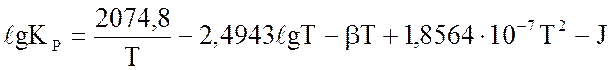 , (3.8)
, (3.8)
где β – коэффициент, зависящий от давления, J – константа интегрирования.
Значения β и J в зависимости от давления представлены в таблице 3.1.
По уравнению (3.7) с использованием уравнения (3.8) рассчитываем равновесные концентрации аммиака при различных давлениях и температурах.*
----------------------------------------------------------------------------------------------------* Предложенный метод расчета приближенный. Для точного расчета в уравнение для константы равновесия следует подставлять не парциальные давления компонентов, а парциальные летучести, определение которых является весьма трудной задачей.
Таблица 3.1.
Значения β и J при различных давлениях
|
Давление, МПа |
β |
J |
Давление, МПа |
β |
J |
|
1 |
0 |
-1,933 |
30 |
1,256∙10-4 |
-2,206 |
|
3 |
3,4∙10-5 |
-2,021 |
60 |
1,0856∙10-3 |
-3,059 |
|
5 |
1,256∙10-4 |
-2,090 |
100 |
2,6833∙10-3 |
-4,473 |
|
10 |
1,256∙10-4 |
-2,113 |
Уравнение (3.7) предполагает, что в исходной реакционной смеси содержатся только азот и водород и отсутствуют инертные примеси. Равновесную концентрацию аммиака в присутствии инертов можно пересчитать с использованием следующего выражения:
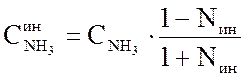 (3.9)
(3.9)
Цель работы
Изучить влияние температуры давления и содержания инертных примесей на равновесную концентрацию аммиака в реакционной смеси. Представить полученные результаты в виде графиков и объяснить их и сделать соответствующие выводы.
Порядок выполнения работы
Запустить имитатор лабораторной работы.
Имитатор к лабораторной работе позволяет при различных температурах, давлениях и разном содержании инертных примесей в исходной азотоводородной смеси равновесное содержание аммиака в газе.
Пользуясь описанием имитатора к лабораторным работам, (см. приложение) установить, согласно заданию, интервал и шаг изменения температуры на термометре, давление и содержание инертных примесей. После того как все параметры будут установлены, следует нажать кнопку «расчет». В ходе работы можно менять содержание инертов и давление.
Варианты заданий приведены в таблице 3.2.
Полученные расчетные значения равновесных концентраций аммиака заносим в таблицу расчетных величин. Примерный вид таблицы показан ниже: таблица 3.3.
На основании данных, представленных в таблице 3.3. строятся графические зависимости:
- равновесной концентрации аммиака от температуры при различных давлениях и постоянном содержании инертов;
Таблица 3.2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.