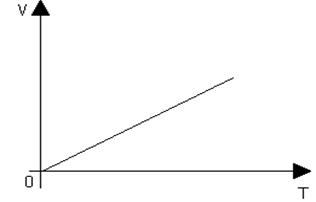
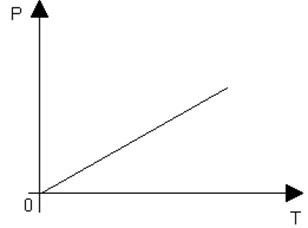
4 m=const и Р - соnst. Процесс с постоянным давлением называется изобарическим. Используя уравнение Клапейрона – Менделеева, установим связь между объемом и абсолютной температурой:
pV=(m/M)RT=>V/T=(mR)/(Mp)=const, т.е.
V/T=const или (V1/T1)=(V2/T2)
При изобарическом процессе объем идеального газа прямо пропорционален его абсолютной температуре. Графическая зависимость изображена на рисунке 12.
Эта связь была установлена французским физиком Гей-Люссаком.
Адиабатный процесс
Процессы, проходящие в системе, которая не вступает в теплообмен с окружающей средой, называются адиабатными.
Согласно определению Q=0, исходя из первого начала термодинамики, при адиабатных процессах
ΔU = А,
т.е. изменение внутренней энергии в таких процессах определяется работой, совершенной системой, или над ней. При расширении, когда газ как система совершает работу, его внутренняя энергия убывает, что приводит к охлаждению газа, т.к.
ΔU=3mR(T2-T1)/(2M), ΔU<0==>T2<T1
При адиабатном сжатии внутренняя энергия газа возрастает за счет работы внешних сил, что приводит к увеличению температуры газа.
 |
 |
||
В частном виде адиабатные процессы практически не встречаются, поскольку нет идеальной теплоизоляции. Но очень быстрые процессы ложно считать адиабатными, поскольку теплообмен не успевает произойти.
Следовательно, при быстром расширении газы охлаждаются, а при быстром сжатии – нагреваются. Так при выпуске углекислого газа из баллона при большом давлении он охлаждается до низкой температуры и превращается в кристаллическую массу, похожую на снег. Спрессовывая эту массу, получают «сухой лёд». В двигателях внутреннего сгорания типа «Дизель» при быстром сжатии удается поднять температуру газа до 500 - 6000С. Топливо, введенное в цилиндр двигателя, при этом самовозгорается.
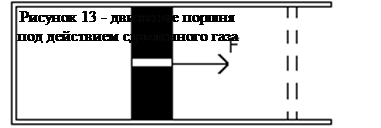
Работа при расширении газа
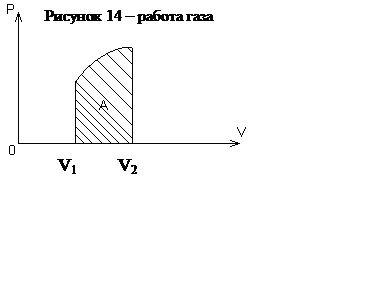
Внутренняя энергия газа частот используется для совершения механической работы. Такие устройства называют пневматическими. В них газ, расширяясь, приводит в движение подвижную часть устройства, например поршень (рисунок 13). Пусть газ расширяется при постоянном давлении. Это значительно упростит вычисление. Работа в таком случае будет А = F1, но F = рS => А = рS1. Нетрудно понять, что Sl - изменения объема газа, следовательно,
А = рΔV или А=P(V2-V1).
Работа газа при постоянном давлении определяется произведением давления на изменение объема газа. На графике в координатах р, V работа изображается площадью диаграммы как указано на рисунке 14.
 |
 |
||
Второе начало термодинамики
Все процессы в природе можно разбить на две группы – обратимые и необратимые. Если система при прямом и обратном процессе проходит через одни и те же промежуточные состояния без каких-либо изменений в окружающих эту систему телах, то также процессы называют обратимыми. Любой процесс, не удовлетворяющий этим условиям, называется необратимым. Рассмотрим ряд примеров. Нам известно, что при абсолютно упругом ударе энергия не теряется. Если абсолютно упругий шарик падает на абсолютно упругую плиту в вакууме, то нетрудно понять, что процесс будет обратимым. После отражения шарик вернется в исходное состояние и процесс повторится. Также легко убедиться, что колебание маятника без учета трения можно отнести к разряду обратимых процессов. Но в природе встречается огромное количество процессов, которое явно носят выраженный необратимый характер. Примером может служить диффузия, при которой происходит самопроизвольное выравнивание концентраций. Если в воду бросить кусочек сахара, то он растворится по всему объему воды. Обратный же процесс сам по себе никогда не произойдет: сколько бы мы не ждали, молекулы сахара в воде снова и кусочек не соберутся. Конечно, мы можем испарить воду и выделить снова сахар, но это потребует, чтобы в окружающих телах произошли определенные изменения. Так, нагревая воду, мы затратим энергию на нагрев, испарение. Итак, диффузия является односторонним, а тем самым и необратимым процессом. Опыт показывает, что теплообмен, как и диффузия, является односторонне направленным процессом, носит необратимый характер. Каждому известно, что при теплообмене энергия передается от тел с более высокой температурой к менее нагретым телам, и никогда не наблюдалось, чтобы энергия в форме тепла переходила сама по себе от холодных к горячим телам. Таким образом, без каких-либо внешних воздействий, в природе невозможен процесс, единственным результатом которого была бы передача энергии в форме тепла от холодного тела к горячему. Это положение называют вторым началом термодинамики. Первое начало говорит о том, что при тепловых процессах энергия сохраняется, а второе начало указывает на направление передачи энергии при теплообмене.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.