Пусть в некотором сосуде заключен газ. Молекулы, двигаясь хаотично, сталкиваются со стенками сосуда и производят давление. Это явление определяется числом ударов, производимых молекулами за единицу времени на единицу площади поверхности сосуда.
 Сила ударов молекулы, а, следовательно,
и давление молекулы зависит от скорости и массы молекул. Но от скорости и массы
молекул зависит кинетическая энергия, следовательно, имеется возможность выразить
давление газа на стенки сосуда через кинетическую энергию молекул и их число.
Сила ударов молекулы, а, следовательно,
и давление молекулы зависит от скорости и массы молекул. Но от скорости и массы
молекул зависит кинетическая энергия, следовательно, имеется возможность выразить
давление газа на стенки сосуда через кинетическую энергию молекул и их число.
Вычисления показывают, что давление газа будет
P=(2/3)nWk
где n - число молекул в единице объема. Это уравнение называют основным уравнением кинетической теории газов. Таким образом, среднюю кинетическую энергию молекул газа можно найти:
Wk=(m0ν2KB)/2, Wk=kT3/2, Wk=(3p)/(2n)
Внутренняя энергия идеального газа
Внутренняя энергия идеального одноатомного газа легко вычисляется. Вспомним, что молекулы идеального газа не взаимодействуют из-за наличия больших межмолекулярных промежутков и, как условились ранее, энергия взаимодействия равна нулю. Значит, внутренняя энергия идеального газа определяется только кинетической энергией движения молекул
U=ΣWk=NWk
где N - число всех молекул газа, а Wk – средняя кинетическая энергия одной молекулы. Вычислим внутреннюю энергию идеального газа, учитывая, что где m - масса всего газа, νкв – средняя скорость молекул. Теперь учтём, что
Wk =kТЗ/2,
тогда U=N(3/2)kT=(3/2)(m/M)NAkT, где m/М - число киломолей,
NA – число Авогадро Произведение NA k заменим одной постоянной величиной R, которую называют универсальной газовой постоянной, т.е. R=NAk. Учитывая это обозначение
U=(3m/2M)RT,
Причём R=6,023×1026 1/кмоль×1,38-23Дж/К=8,314×103Дж/кмольК
Существует ещё один путь вычисления внутренней энергии, через основное уравнение кинетической энергии
U=3p/2n=(3/2)p(n/N)=(3/2)pN
Таким образом, мы проследили возможные пути вычисления внутренней энергии идеального газа.
 |
Состояние любого газа характеризуется его массой,давлением, объемом итемпературой.При изменении одного из параметров изменяются и другие параметры, значит, между ними существует определенная связь, которую легко установить. Вспомним, что внутреннюю энергию газа можно находить
U=(3/2)pV и ν=(3/2)(m/M)RT.
Так как речь идет о внутренней энергии одного и того же газа, то рV/2 = 3RTm/2M =>pV=RTm/M, полученное уравнение называют уравнением Клапейрона - Менделеева. Произведение давления и объема газа равняется произведению числа киломолей, универсальной газовой постоянной и абсолютной температуры.
Нетрудно заметить, что уравнение Клапейрона - Менделеева отражает закон сохранения энергии для идеального газа.
Частные случаи уравнения Клапейрона - Менделеева
Если в уравнении Клапейрона - Менделеева принимать некоторые из параметров постоянными, то получим ряд частных уравнений:
1 m=CONST, pV=RTm/M=>pV/T=CONST
Это уравнение часто называют уравнением состояния
идеального газа или объединенным газовым законом. Его часто записывают в
следующей форме 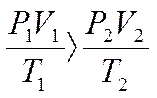
2 Допустим, что m=CONST и T=CONST
Такие процессы называют изотермическими. Учитывая это, нетрудно заметить, что в уравнении pV=RTm/M, правая часть будет постоянной при любых изменениях давления и объема pV=CONST или же p1V1= p2V2 .При постоянной массе и температуре объём газа обратно пропорционален давлению закон Бойля-Мариотта.
В координатах p, V процесс изображается гиперболой. Рисунок 10
3 m=CONST и V= CONST. Процесс с постоянным объемом называют изохорическим.
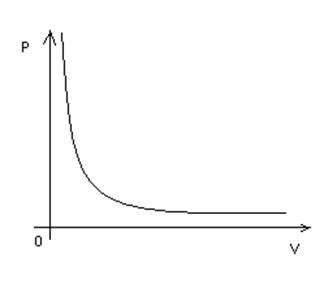
Рисунок 10 – изотермический процесс
Используя уравнение Клапейрона – Менделеева, установим, что:
pV=RTm/M => p/T×m/M×RV, то есть p/T=CONST
Или же р1/Т1=р2Т2 . При изохорическом процессе давление идеального газа прямо пропорционально его абсолютной температуре. Эта связь была открыта французским физиком Шарлем и называется закон Шарля. График процесса изображен на рисунке 11.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.