МАК им своей поверхности путем образования везикул- Обработка ялросодержаших клеток (например, опухолевые клетки) антителами и комплементом приводит к разбуханию митохондрии и мембран эндоплазматического ретикулума клеток, а также к увеличению размеров перинуклеарных пор. В результате повреждения проницаемости клеточных мембран происходит потеря клеткой К4', аминокислот, рибонуклеопротеинов, ферментов и других нуклеотидов с последующим осмотическим лизисом клеток.
Альтернативный путь активации комплемента
Начальным компонентом комплемента, который инициирует "альтернативную" активацию всей системы, является СЗ. Циркулирующий в крови СЗ может подвергаться медленному спонтанному гидролизу тиоэфирной связи в а-цепи молекулы. СЗ с измененной тиоэфирной связью не расщепляется на субкомпоненты СЗа и СЗЬ, но приобретает свойства, делающие его
тождественным СЗЬ. Так, в присутствии Mg такой гидролизо-ванный СЗ приобретает способность связывать циркулирующие в крови фактор В системы комплемента, нативный СЗ и фактор Н, а также взаимодействовать с клеточными рецепторами эритроцитов и фагоцитов к СЗЬ.
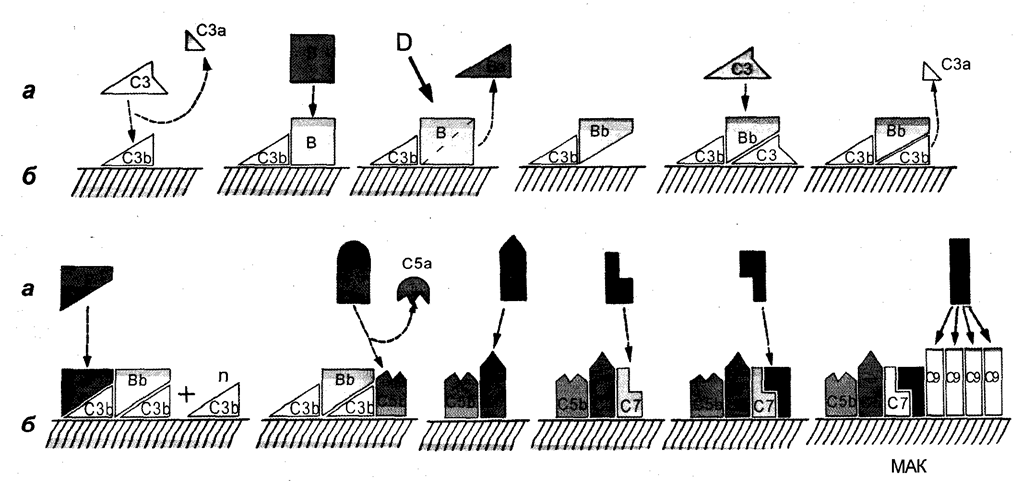
Рис. 5. Альтернативный путь активации системы комплемента.
д — компоненты комплемента в водной фазе; 6 — компоненты комплемента, иммобилизованные на мембранах клеток.
Циркулирующий в крови фактор В является гликопротеи-ном сыворотки с мол. массой 93 кД. Молекула фактора В состоит из одной полипептидной цепочки. Фактор В отличается полиморфизмом и является сериновой протеазой. Фактор В образует двухмолекулярный комплекс как с гидролитически измененным СЗ, так и с СЗЬ. Фактор В в составе комплекса С3(гид-ро)В или СЗЬВ подвергается ферментативному расщеплению фактором D плазмы крови с образованием комплекса СЗЬВЬ и высвобождения Ва-фрагмента. Расщепление фактора В под влиянием фактора D происходит только в том случае, если фактор В ассоциирован с СЗ(гидро) или СЗЬ в виде бимолекулярного комплекса (рис. 5). Освобождающийся от фактора В субкомпонент Ва имеет мол. массу 30 кД, а ВЬ — 60 кД. ВЬ в комплексе с СЗ(гидро) или СЗЬ способен фиксировать и расщеплять СЗ на СЗа- и СЗЬ-субкомпоненты, т. е. выступает в качестве СЗ-конвертазы альтернативного пути активации комплемента. Свободный ВЬ может расщеплять протромбин и некоторые синтетические пептиды. ВЬ обладает также способностью активировать плазминоген. В норме спонтанное образование гид-ролизованного СЗ происходит на крайне низком уровне. Но в том случае, если в организме образуются СЗЬ и эти молекулы посредством тиоэфирной группы фиксируются на мембране чужеродных клеток, процесс образования комплексов СЗЬВЬ осуществляется весьма активно, обеспечивая альтернативную активацию системы комплемента. Фиксация СЗЬВЬ на мембранах обеспечивает иммобилизацию и расщепление псе новых и новых молекул СЗ и п результате этого — образование мультимолекулярных белковых комплексов типа (СЗЬ)пВЬ. Комплекс (СЗЬ)пВЬ обладает свойствами СЗ-конвертазы и может фиксировать и расщеплять С5 на С5а- и С5Ь-субкомпоненты. В дальнейшем процесс образования мембраноатакующего комплекса белков комплемента не отличается от такового при классическом пути активации системы. Комплекс СЗЬВЬ нестабилен, и при 30°С половина молекул комплекса диссоциирует, утрачивая активность конвертазы, через 4—5 мин. Стабилизация этого молекулярного комплекса достигается при присоединении к комплексу молекулы пропердина. Пропердин является гликопро-теином с выраженными катионными свойствами, тетрамер-ным белком с мол. массой 220 кД и образуется из четырех идентичных субъединиц. Пропердин может образовывать комплексы не только с СЗЬВЬ и с (СЗЬ)пВЬ, но и с СЗ, СЗЬ и СЗс. Стабилизируя комплекс (СЗЬ)пВЬ, Пропердин в течение длительного времени сохраняет активность комплекса (СЗЬ)пВЬ как С-5-конвертазы. (СЗЬ)пВЬР. подобно С5-конвертазе классического пути активации комплемента, способен фиксировать и расщеплять молекулу С5 в том же участке на С5а- и С5Ь-субкомпоненты.
В инициации процесса активации комплемента альтернативным способом весьма важным условием является фиксация гидролизованного СЗ или СЗЬ на поверхности клеток или частиц, поскольку свободно циркулирующий СЗЬ легко взаимодействует с фактором Н и, будучи в комплексе СЗЬН, быстро инактивируется фактором I. Фактор Н, как и фактор I, в норме присутствуют в плазме крови в количествах, значительно
превышающих необходимые для быстрой" инактивации, появляющиеся в циркуляции СЗЬ.
Расщепление фактора В, находящегося в комплексе с СЗЬ, осуществляется фактором D. Фактор D построен из одной полипептидной цепочки, имеет мол. массу 24 кД, при электрофорезе мигрирует с сывороточными р-глобулинами. Фактор D обладает активностью сериновых протеаз, но в отличие от других сериновых протеаз характеризуется узкой субстратной специфичностью. Естественным субстратом для фактора D как протеазы является фактор В, но только находящийся в виде бимолекулярных комплексов типа СЗ(гидро)В или СЗЬВ. Фактор D отличается низкой чувствительностью к сывороточным ингибиторам протеаз.
Взаимодействие СЗЬ с клетками отличается определенной избирательностью и легко осуществляется благодаря высокому сродству СЗЬ к липополисахаридам клеточных стенок бактерий, зимозану клеточных стенок дрожжей, полисахаридам чужеродных эритроцитов. Избирательность в фиксации СЗЬ на мембранах чужеродных клеток, сопровождающаяся активацией системы комплемента альтернативным способом, обеспечивает в организме
примитивное распознавание чужеродных (микробных) антигенов.
В фиксации СЗЬ на клетках существенна также роль сиа-ловых кислот и рецепторного белка на мембране клеток, а также гепарина. Уменьшение на клетках содержания сиало-вых кислот (например, под влиянием вирусных нейраминидаз) увеличивает сродство СЗЬ к мембране и фактору В и уменьшает аффинитет к фактору Н. Гепарин. имеющий структурное сходство с гепарин-сульфатом, который является одним из нормальных компонентов клеточных стенок фибробластов, эндоте-лиальных и других клеток, снижает способность клеток или частиц активировать комплемент альтернативным способом. Иммобилизация гидролизованного СЗ или СЗЬ на мембране клеток
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.