С4 построен из трех полипептидных цепочек: а-95 кД, р-70 кД, т-33 кД, удерживаемых вместе с помощью межцепочечных дисульфидных связей. Под влиянием Cls-эстеразы от а-цепи С4 освобождается небольшой С4а-фрагмент (мол. масса
9 КД) П остается С4Ь-фрагмечт (мол. масса 180 кД). В ПРИСУТСТВИИ ионов Mg24'C4b ассоциируется с С2-белком. В этом
двухмолскулярном комплексе С4Ь2, С2 ПОД ВЛИЯНИеМ ClS-ЭС-
теразы расщепляется на С2Ь-фрагмент (мол. масси зо кД) и удерживаемый в комплексе с C4b фрагмент С2а (мол. масса 70—83 кД). Таким образом, в ассоциации с иммунным комплексом оказывается еще несколько белков системы комплемента и их фрагментов (С4Й, 2а). Этот димолскулярный комплекс нестабилен и достаточно быстро распадается (период ПО-
лураспада 12 мин). Димолекулярный комплекс С4Ь2а в свою очередь обладает протеолитической активностью и способен взаимодействовать с СЗ-компонентом комплемента плазмы крови, а затем и расщеплять его на субкомпоненты СЗа (мол. масса 9 кД) и СЗЬ (мол. масса 170 кД). Благодаря своей активности в отношении СЗ-компонента комплемента белковый комплекс С4Ь2а получил название СЗ-конвертазы классического пути активации системы комплемента.
СЗ-гликопротеин занимает ключевую позицию во всей системе комплемента, участвуя в активации системы как классическим, так и альтернативным способом. СЗ-компонент комплемента построен из дисульфидно-связанных а- и р-поли-псптидных цепочек с мол. массой соответственно 110 и 90 кД. В а-цепи между глутамином и отдаленным от него на 3 аминокислоты цистеином имеется тиоэфирная связь, которая придает полипептидной цепочке СЗ скрученную конфигурацию. Тиоэфирная связь нестабильна, и при ее расщеплении освобождающаяся карбонильная группа глутамина в тиоэфир-ной связи легко взаимодействует с другими молекулами. Именно благодаря этому СЗЬ прочно фиксируется на поверхности разнообразных клеток-мишеней.
Субкомпонент СЗа, освобождающийся из а-цепи при расщеплении белка СЗ (рис. 3), обладает свойствами анафилаток-сина и выраженной хемотаксической активностью. Сывороточная карбоксипептидаза-В отщепляет у поступающего в циркуляцию СЗа, как и у С4а, концевой остаток аргинина (СЗа-дез-Арг, С4а-дез-Арг), существенно снижая в результате этого их биологическую активность и, в частности, способность СЗа и С4а взаимодействовать с имеющимися у разных клеток человека и животных рецепторами к СЗа и С4а.
Образующийся субкомпонент СЗЬ или взаимодействует с иммобилизованными комплексами из С4Ь2а-белков (образуется трехмолекулярный комплекс C4b2a3b), или поступает в плазму, где может участвовать в активации комплемента альтернативным способом или взаимодействовать с клетками, обладающими рецепторами к СЗЬ. Иммобилизованный СЗЬ способен также взаимодействовать с lgG-глобулинами, и такой биомолекулярный комплекс обладает высокой опсонизирующей активностью.
При последующей инактивации СЗЬ расщепляется на более мелкие фрагменты. Такими образующимися из СЗЬ фрагментами являются субкомпоненты C3dg (мол. масса 41 кД) и СЗс (мол. масса 143 кД). Под влиянием протеолитических ферментов крови (плазмин, трипсин, катепсины О, эластаза лейкоцитов) C3dg рас-шепляется на субкомпоненты C3d (мол. масса 33 кД) и C3g (мол. масса 8 кД), которые в свою очередь или взаимодействуют с соответствующими рецепторами разных клеток, или подвергаются дальнейшей биодеградации. СЗс под влиянием трипсина плазмы расщепляется до фрагментов СЗе (мол. масса 12 кД), а последние — до олитопептидов и аминокислот.
Рис. 2. Модель молекулы Clq-субкомпонента комплемента.
Трехмолекулярный комплекс C4b2a3b способен взаимодействовать на С5 и, обладая пептидазной активностью, расщепляет С5 (мол. масса 190—200 кД) на субкомпоненты С5а (мол. масса 11—15 кД) и С5Ь (мол. масса 180 кД). Благодаря способности раСЩСПЛЯТЬ С5-ко1чпо..еыт C4b2a3b наЗЫПЗЮТ С5-КОН-
вертазой классического пути активации комплемента.
Как и СЗ, С5 построен из двух комплементарных дисульфидно-связанных ПОЛИПСПТИДНЫХ цепочек (ч и р), мол. масса
которых составляет соответственно 115 и 80 кД. Выявлена высокая гомология аминокислотной последовательности пептидных цепочек С5 и СЗ, а у С4 с аз-макроглобулинами плазмы.
Высвобождающийся при расщеплении С5 субкомпонент
С5а также обладает активностью анафиЛаТОКСИНа И СПОСООНО-
стью стимулировать хемотаксис, фагоцитоз и диграмуляцию ряда клеток. Клетки, взаимодействующие с С5а, выделяют различные медиаторы и цитокины, изменяющие тонус гладкой мускулатуры бронхов и сосудов и повышающие проницаемость сосудистой стенки. Именно благодаря этой активности С5а является активным анафилатоксином и спазмогеном. Биологическая активность С5а как активатора секреции из клеток различных медиаторов воспаления почти в 500 раз выше, чем СЗа. Однако свободный С5а также чувствителен к сывороточной карбоксипептидазе, удаляющей у С5а остаток аргинина. Молекула С5а-дез-Арг становится в отношении тучных клеток в 1000 раз менее активной, чем С5а, хотя и сохраняет способность почти с той же активностью стимулировать моноциты и полиморфно-ядерные лейкоциты.
С образованием С5Ь запускается активация компонентов комплемента атакующих мембраны клеток. Эти белки комплемента, последовательно взаимодействуя друг с другом, образу-
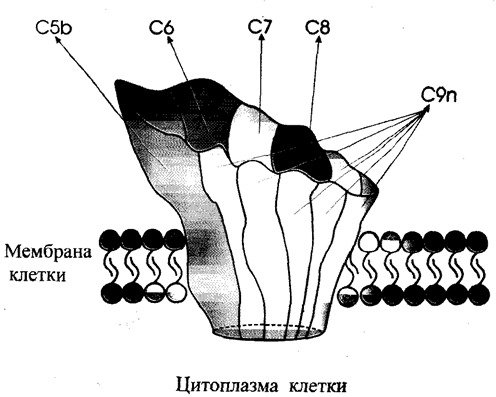
Рис. 4. Модель встроенного в липидный бислой клеток МАК.
ют мультимолекулярный комплекс, способный атаковать ли-пидные мембраны разнообразных клеток (мембраноатакующий комплекс), и, встроившись в них. дырявить наружные клеточные мембраны и вызывать лизис клеток. Белки мембраноата-кующего комплекса комплемента относят к третьему блоку комплементарных белков. Сборка мембраноатакуюшего комплекса (МАК) начинается с С5Ь (см. рис. 1). Фиксированная на мембране молекула С5Ь имеет участок, взаимодействующий с белком С6, так что в результате такого взаимодействия образуется эквимолекулярный комплекс С5ЬС6, иммобилизованый на липидной мембране клетки. По некоторым данным. С6 обладает слабой активностью ссриновой протеазы. которая, возможно, обязана примесям, присутствующим в выделяемых препаратах С6. С6 и С7 обладают сходными физико-химическими свойствами и являются одноцепочечными гликопротеинами, мол. масса которых составляет соответственно 104—128 и 92—120 кД. Комплекс С5Ь6 взаимодействует с С7, образуя трехмолекулярный комплекс С5Ь67. С7 плазмы характеризуется амфофильны-ми свойствами и при взаимодействии с С5Ь6 гидрофобный участок С7 обеспечивает прочную фиксацию всего трехмолекулярного комплекса на фосфолипидах наружной клеточной мембраны. Если связывания комплекса с мембраной клеток не происходит, трехмолекулярный комплекс С5Ь67 образует растворимую белковую мицеллу с константой седиментации 36 S. При
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.