Математически это выражается формулой:
![]() .
(2.12)
.
(2.12)
Не существует такого замкнутого, возвращающего систему в прежнее состояние цикла, при котором увеличилась бы внутренняя энергия системы.
Из уравнения (2.11) следует, что подведенное к системе тепло идет на увеличение внутренней энергии системы и на совершение внешней работы.
Применительно к химическому процессу закон можно пояснить на примере реакции 2Н2 + О2 = 2Н2О. При этой реакции, как известно, освобождается энергия (выделяется теплота). Этот факт можно объяснить тем, что внутренняя энергия исходных веществ, двух молей водорода и одного моля кислорода больше внутренней энергии двух молей воды, получаемых в результате реакции. Выделенная теплота идет на совершение работы расширения газа.
Для идеального газа при условии, что dW’=0 вместо уравнения (2.11) можно записать:
dQ = dU + pdV(2.13)
В результате интегрирования последнего выражения имеем:
Q=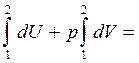 DU+
рDV
(2.14)
DU+
рDV
(2.14)
Выражение (2.14) является математической записью уравнения первого закона термодинамики в конечных разностях, представляющих достаточно большие количества теплоты, (перед Q не ставится какой - либо указатель) и достаточно большие изменения внутренней энергии (DU) и объема (DV).
Следует отметить, что для открытых систем математическое выражение первого закона записывают с учетом тепло - и массообмена таким образом:
dU = dQ - dW+ dEM +dE* (2.15)
где: dEM иdE* вклады в изменение энергии, связанные с изменением массы системы (массообменом) и обменом энергией между системой и окружающей средой соответственно.
Изохорный процесс:
С учетом того, что dQ= dU+ рdV имеем при V-const:;
Qv=DU (2.16)
Это означает, что вся теплота в изохорном процессе расходуется на увеличение внутренней энергии.
Изобарный процесс. При P-const из выражения (2.13) следует, что
dQ=d(U+рV) (2.17)
Обозначая U + pV через Н, имеем
dQ = dН (2.18)
где: p – давление, V – объем рассматриваемой системы, Н - энтальпия, являющаяся функцией состояния системы.
Интегрирование уравнения (2.13) приводит к равенствам (2.19) -(2.22)
dQ=dU+r![]() dV;
(2.19)
dV;
(2.19)
Q=(U2+PV2)-(U1+PV1)=H2-H1(2.20)
Q =DH (2.21)
Таким образом, для определения теплоты процесса, протекающего при постоянном давлении достаточно знать изменение энтальпии процесса.
Основы термохимии первым в России, по-видимому, заложил М.В. Ломоносов. Он установил, что при химических реакциях обязательно выделяется или поглощается теплота. В дальнейшем эту теплоту связали с тепловым эффектом химической реакции, а науку, изучающую тепловые эффекты химических реакций назвали термохимией.
Теплота химической реакции имеет природу внутренней энергии. Она складывается из изменений энергии связей атомов и молекул, а также изменения межмолекулярного взаимодействия.
Определение теплового эффекта.
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате реакции при соблюдении следующих условий:
· Объем или давление реакционной системы постоянны;
· Не совершается какой-либо другой работы, кроме работы расширения газа, т.е. W’ =0. Невыполнение этого условия (это имеет место в электрохимической ячейке) приводит к тому, что теплота реакции меняется.
· Температура исходных веществ и продуктов реакции одинаковы, т.е. Т1= Т2.
· Тепловой эффект отнесен к молю вещества. Поэтому его выражают в Дж или кДж/ моль.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.