[12] Количественным аналогом этой формулировки является следующее соотношение между теплотой и работой: 1 кал = 4,186 Дж.
[13] Теплота сгорания пищевых продуктов в живом организме является источником энергии, за счет которой осуществляется жизнедеятельность.
[14] В том случае, если агрегатное состояние вещества всегда известно или очевидно, оно в термохимическом уравнении не указывается.
[15] Таким образом температура не является нормируемым параметром при выборе стандартного состояния. Однако широкое применение температуры 298,15 К в справочных таблицах сделало эту температуру как бы стандартизированной величиной.
[16] Иногда стандартные величины относят к процессам, протекающим при стандартных условиях. «Для химической реакции стандартные условия означают равенство температур реагентов и продуктов реакции и поддержание для каждого газообразного вещества постоянного давления равного 1 атм» [2].
[17] В случае твердых и жидких веществ теплоту диссоциации заменяют теплотой сублимации или испарения соответственно
[18] Часто удельную теплоемкость при простоянном давлении называют "массовой удельной теплоемкостью".
[19] Здесь приведены лишь наиболее важные для понимания представляемого курса физической химии формулировки второго закона.
[20]Можно заметить, что математические формулы для теплоемкости и изменения энтропии в обратимых процессах записываются одинаково (Собр=dQобр/dT сравни с dS=dQобр/dT), одинаковы и единицы измерения (Дж/моль×К), что конечно не проявляется в их разном физическом смысле, который иногда трактуют, анализируя математическое выражение.
[21]Эта формулировка второго закона термодинамики послужила основой для, высказанного Клаузиусом утверждения о возможности тепловой смерти Вселенной.
[22] Прокомментировать «обесценивание « энергии позволяет представление энтропии, как доли связанной энергии, отнесенной к единице температуры. Под связанной энергией понимают часть внутренней энергии, которая ни при каких условиях не может быть превращена в работу.
[23] Эта формулировка включает постулат М. Планка, сформулированный в 1911 году. Согласно этому постулату энтропия вещества с идеальной кристаллической решеткой равна 0. Под идеальной кристаллической решеткой понимается кристаллическое образование без каких либо дефектов или включений примесей.
[24]Термин «свободная энергия» введен в 1882 г. Гельмгольцем. Он используется для обозначения той части внутренней энергии, которая может быть преобразована в работу.
[25] Характеристические функции - это функции состояния, которые вместе со своими производными по соответствующим параметрам позволяют в явном виде выразить любые термодинамические свойства.
[26] Теорема о произведении частных производных.
Если три величины x, e, z связаны функциональной зависимостью
вида f(x,y, z) =0, то между частными производными от этих величин
существует соотношение ![]() . Из этого
соотношения, в частности, следует, что поскольку x,
y, z связаны функциональной зависимостью, то любую
из этих величин можно считать функцией двух других величин. Например, если рассматривать
х как функцию y, zтогда
можно записать, что
. Из этого
соотношения, в частности, следует, что поскольку x,
y, z связаны функциональной зависимостью, то любую
из этих величин можно считать функцией двух других величин. Например, если рассматривать
х как функцию y, zтогда
можно записать, что 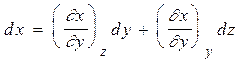
Теорема о приравнивании накрест взятых производных. Для выражения полного дифференциала вида dz = Xdx + Ydy,
где X= f1(x, y) , а Y = f2(x, y) частная производная от коэффициента X ,
взятая по y при x =
const, равна частной производной от коэффициента Y,
взятой по х при у = const, т.е. ![]()
[27] Можно отметить, что частные производные легко определить графическим способом. Рассмотрим выражение dG = Vdp - SdT. Из него следует, что для p=const dG = - SdT. Решая последнее уравнение графически, нетрудно получить величину -S, как тангенс угла наклона графика зависимости GотT.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.