|
Условия протекания процесса |
Функция |
Самопроизвольный dW > 0 |
Равновесный dW= 0 |
|
Система неизолированная |
|||
|
V, S = const |
U= Q - PV |
dU < 0 |
dU = 0 |
|
V, T = const |
F = U - T×S |
DF< 0 |
DF = 0 |
|
S, p = const |
H = U + pV |
DH < 0 |
DH = 0 |
|
p, T = const |
G = U + p×V-T×S |
DG < 0 (dG = 0) |
DG = 0 (dG = 0) |
Если работа процесса равна 0, то такой процесс считается равновесным. Например, изотермически равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса до достижения минимума, после чего изменения потенциала оказываются невозможными, иначе говоря равными нулю. Этому минимуму отвечает термодинамически равновесное состояние системы.
Аналогичный анализ можно выполнить и относительно других термодинамических функций (см. табл. 2.7).
Использование термодинамических функций для
построения математического аппарата термодинамики
Как видно из схемы, показывающей взаимосвязи между основными законами и принципами равновесной термодинамики, понятийный аппарат термодинамики основан на использовании законов и принципов термодинамики, а математический аппарат представлен уравнениями, связывающими термодинамические функции и их производные с физико- химическими свойствами и между собой. В связи с таким использованием термодинамических функций их часто называют характеристическими функциями[25].
Следует отметить, что большинство термодинамических формул самостоятельного значения не имеют. Они предназначены для решения очень узкой проблемы, а именно: для связывания конкретных функций через термодинамические параметры. Поэтому в термодинамике существует множество формул. Методика их вывода достаточно проста. Почти все они получаются применением двух простых математических теорем: теоремы о произведении частных производных и теоремы о приравнивании накрест взятых производных[26].
Примером образования термодинамических формул с использованием термодинамических функций и их производных может служить вывод уравнений Гиббса - Гельмгольца.
Эти уравнения позволяют избежать использование в явном виде зависимостей термодинамических функций (G, A) от энтропии, выступающей в качестве независимой переменной.
Рассмотрим вывод уравнения для условий p = const, T = const.
В этом случае по определению имеем:
G = U + pV - TS (2.61)
Выведем полный дифференциал функции G.
dG = dU + pdV - TdS + Vdp - SdT (2.62)
На основании уравнения (2.56) при условии, что dW’= 0 можно записать:
TdS = dU + pdV (2.63)
Сочетая уравнения (2.62) и (2.63) получаем:
dG = Vdp - SdT (2.64)
Из математики известно, что полный дифференциал любой функции может быть выражен с помощью частных производных этой функции по соответствующим переменным. Поэтому, рассматривая в качестве независимых переменных Т и р, для функциональной зависимости вида G= f(T,p) нетрудно вывести выражение:
 (2.65)
(2.65)
Сравнивая уравнения (2.64) и (2.65) можно получить, что:
 и
и 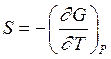 (2.66)
(2.66)
Из уравнений (2.66) следует, что термодинамические параметры и функции можно представлять в виде частных производных[27].
Подставим выражение для энтропии (2.66) в уравнение (2.57). В результате получаем уравнение Гиббса –Гельмгольца для энергии Гиббса:
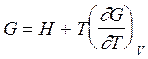 (2.67)
(2.67)
На основе формул- определений вида (2.59 а) и (2.60 а), а также соответствующих производных для других термодинамических функций можно получить уравнения семейства уравнений Гиббса –Гельмгольца для любых функций.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.