1. Определите изменение энтропии при изотермическом увеличении объема 1 л азота до объема 2 л. При давлении и температуре равных соответственно 2 атм и 298 К.
Решение
Предположим, что газ идеальный. Это позволяет определить количество молей азота в заданной системе с помощью уравнения (1.3) pV = nRT.
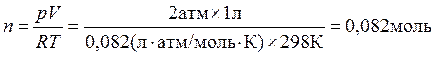
С учетом уравнения (2.47 а) 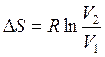 найдем DS:
найдем DS:
DS = 0,082 моль×8,314(Дж/моль×К) ln 2 = 0,47 Дж/К
2. Вычислите изменение энтропии при испарении 1 моля воды при 100° С, если известно, что удельная теплота испарения (DHисп) при этой температуре равна 2254,8∙103 Дж/кг.
Решение
Испарение является обратимым изотермическим процессом, протекающим при постоянной температуре. Поэтому к нему можно применить следующее уравнение: DS = Sг - Sж = DHисп/Tкип
С учетом того, что молярная теплота испарения равна DHуд·18 имеем:
DS= 2254,8∙18/(273,2+100) = 108,77 Дж/моль∙К
2.4. ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ
Экспериментально в конце 19 века было показано, что при приближении к абсолютному нулю величина Ср стремится к 0, т.е.
lim Ср.= 0, если Т® 0 К.
Поэтому отношение Ср /Т конечно или равно 0. На основании этого положения с учетом уравнения (2.49) можно утверждать, что разность ST - So всегда положительна или равна 0.
Из этого утверждения вытекают формулировки третьего закона термодинамики, в том числе:
· Всякое вещество имеет конечную положительную энтропию, которая при абсолютном нуле может стать нулевой и действительно равна нулю в случае идеальной кристаллической решетки[23].
· «Энтропия приобретает нулевое значение при любом давлении, коль скоро тело охлаждено до абсолютного нуля». Тепловая теорема Нернста в формулировке К.А. Путилова [20].
Надо отметить, что выводы третьего закона термодинамики вполне согласуются с уравнением Больцмана имеющего вид (2.9): S = k×lnw. Согласно этому уравнению для w.= 1 величина S = 0. Вместе с тем известно, что термодинамическая вероятность равна единице в одном случае, а именно, если макросостояние отвечает идеально правильно построенному кристаллу. Из этого заключения также вытекает и то, что газы, жидкости, аморфные фазы и растворы не должны подчиняться третьему закону термодинамики.
Третий закон термодинамики предоставляет возможность рассчитывать абсолютную величину энтропии при любой температуре.
Действительно, в соответствие с этим законом для идеального кристаллического вещества правомерно равенство: So=0. Поэтому из уравнения (2.51) следует, что для моля вещества:
ST=Cp×ln(TТ/T0) (2.53)
Величину Cpможно вычислить по формуле Дебая, применимой для расчетов вблизи абсолютного нуля:
Cp=a Т3 (2.54)
КОНТРОЛЬНОЕ ЗАДАНИЕ И ВОПРОСЫ
Выберите и обоснуйте правильное утверждение.
Энтропия кристаллического вещества по сравнению с тем же количеством паров этого вещества:
а) больше;
б) меньше;
в) одинакова.
При равновесном изотермическом сжатии энтропия некоторого количества идеального газа;
г) увеличится;
д) уменьшится;
е) не изменится.
2. В двух сообщающихся сосудах, разделенных перегородкой, находятся 1 моль N2 и 2 моль О2. Рассчитайте изменение энтропии смешения DS после удаления перегородки, если исходные температуры и давления одинаковы, а объем V (N2) =1 л, объем V(O2)= 2 л. Конечное давление равно исходному.
2. Определите DS для нагревания 1 моля азота при постоянном давлении от 300 до 1000 К, Ср =6,4492 + 1,4125×10-3 T –0,807×10-7 T2.
3. Вычислите константу равновесия для реакции СO + 2Н2=С Н3OH(г) при 750 K, если при 25o С Кр=4,1∙10-10 Па2, а DH(750) =-103,5 кДж.
4. Вычислите изменение энтропии при испарении 1 моля хлористого этила при 12,3 ° С, если известно, что DHисп = 376,83 кДж/кг.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.