Пусть моль
идеального газа расширяется от объема V1
до V2.
Примем, что молекулы имеют форму шара с объемом a.
Тогда количество ячеек , которые могут быть заняты в том или ином объемах,
равны соответственно V1/а
и V2./a.
Термодинамические вероятности начального и конечного состояний будут равны: w1=
z(V1/а)N и
w2=
z(V1/а)N.
Поскольку S = k×lnw
можно получить, что 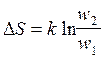 ,
а также:
,
а также: 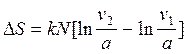 или после сокращения а
имеем:
или после сокращения а
имеем:
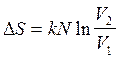 (2.40)
(2.40)
Учитывая, что при расширении идеального газа T=const величина dU =0, в соответствии с уравнением dQ = dU + pdVимеем, что:
dQ = pdV (2.41)
Выразим давление
через объем с помощью уравнения состояния идеального газа формулой p
= RT/V.
Подставим полученное выражение в уравнение (2.41) и получим 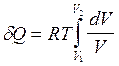 . Отсюда:
. Отсюда:
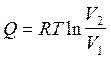 (2.42)
(2.42)
Выразим из последнего уравнения логарифм отношения объемов и подставим его в уравнение (2.40). Это приводит к следующему соотношению:
 (2.43)
(2.43)
Больцман принял, что значение k соответствует равенству k=N/R. При этом условии, в конечном итоге имеем, что:
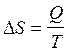 .
(2.44)
.
(2.44)
Полученное выражение является интегральной формой аналитического выражения второго закона термодинамики для обратимых процессов.
Энтропия является
функцией состояния системы. Поэтому ее изменение не зависит от пути протекания
процесса и определяется только начальным и конечным состояниями системы.
Нередко для случая идеального газа целесообразно воспользоваться свойством
аддитивности энтропии, т.е. Sсмеси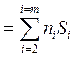
В основе многих расчетов изменения энтропии лежит соотношение:
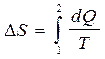 (2.44 a)
(2.44 a)
Нередко полезными оказываются формулы для расчета энтропии, полученные в результате сочетания уравнения (2.44 a) с уравнениями первого закона термодинамики. В частности с учетом уравнения (2.13) и закона Гей-Люссака выражение для первого закона термодинамики можно представить в следующем виде:
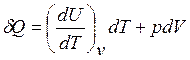 (2.45)
(2.45)
Сочетая уравнения (2.44) и (2.45) можно вывести, что:
dS = (Cv/T) dT +(p/T)dV (2.46)
Интегрирование дает выражение для энтропии при условии, что независимыми переменными являются объем и температура, а n=1моль:
![]()
 или
или 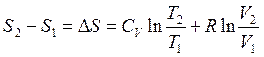 (2.47)
(2.47)
Если процесс протекает при постоянной температуре уравнение (2.47) упростится к виду:
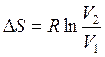 (2.47 а)
(2.47 а)
В общем случае при расчетах изменения энтропии следует учитывать сумму всех возможных изменений энтропии на промежуточных стадиях.
Ниже представлены условия и результаты интегрирования уравнения (2.44) при конкретных условиях, отвечающих той или иной стадии процесса.
· Адиабатический процесс (нет теплообмена): dQ =0; dS = 0.
· Изотермический процесс. Фазовые превращения:
DS
= S2 -S1 =  (2.48)
(2.48)
где DНфп и Тфп -соответственно энтальпия и температура фазового перехода.
· Нагревание при постоянном давлении (изобарный процесс):
Поскольку, как следует из (2.29), dQ =nCpdT с учетом (2.44) имеем:
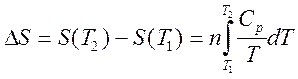 (2.49)
(2.49)
Если теплоемкость постоянна, то результатом интегрирования будет: DS=nCp×ln(T2/T1) (2.50)
· Нагревание при постоянном объеме (изохорный процесс). Из (2.47) следует, что при dV=const:
 (2.51)
(2.51)
· Пример соотношения для расчета изменения энтропии в процессе, включающем фазовый переход. при нагревании вещества при постоянном давлении
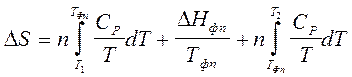 (2.52)
(2.52)
Типовые примеры
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.