Из схемы видно, что основу термодинамики вообще и химической, в частности, составляют первый и второй законы термодинамики. Из первого закона термодинамики вытекают законы термохимии, по сути являющиеся частным проявлением первого закона термодинамики.
При сочетании уравнений, представляющих эти законы, образуются выражения для основного уравнения химической термодинамики и термодинамических функций (потенциалов).
Следует отметить, что подавляющее большинство термодинамических уравнений выводятся с использованием термодинамических функций и их производных. Термодинамические функции служат как бы мостиками, связывающими термодинамические параметры и переменные с различными физико-химическими свойствами веществ.
Несколько особняком стоит третий закон термодинамики. На основе этого закона и связанного с ним постулата Планка оказывается возможным определять абсолютные значения энтропии химических реагентов.
Из концепции термодинамических функций следует принцип минимизации свободной энергии. Этот принцип устанавливает возможность и направление протекания химического процесса в конкретных условиях.
КОНТРОЛЬНОЕ ЗАДАНИЕ
· Пусть термодинамической системой является электролитический ключ С, соединяющий электроды А и В, как показано на рис 2.1. Электроды находятся при разных температурах, которые поддерживаются внешними силами постоянными в течение некоторого промежутка времени температуру. Температура в каждой точке ключа С достигла определенного значения и остается постоянной в течение этого промежутка времени. Электролитический ключ находится в состоянии:
а) стационарном;
б) равновесном;
в) нестационарном и неравновесном.
· Газ, находящийся в идеально эластичной оболочке расширяется в вакууме. Его объем за некоторый промежуток времени увеличился от V1 до V2, па давление упало от р1 до р2. Оцените насколько полученная работа расширения газа Wр отличается от максимально возможной Wрmax[ ]:
г) Wрmax - Wр = 0 ;
д) Wрmax - Wр = р2 (V2 - V1);
е) Wрmax - Wр
= 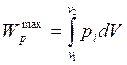
«Если бы в 50 -е годы прошлого столетия был поставлен памятник неизвестному ученому, то наиболее подходящей для него была бы следующая надпись: «В память горя и отчаяния тех, кто пытался создать вечный двигатель»».
Р. Кубо. Термодинамика- М:. Мир, 1970
2.2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон термодинамики, по сути, является законом сохранения энергии. Он выполняется во всех явлениях природы и подтверждается опытом всего человечества, т.е. является аксиомой. Закон лежит в основе миропонимания и поэтому имеет важное мировоззренческое значение[11].
Философское содержание закона сохранения энергии раскрывает формулировка Ф. Энгельса: «любая форма движения способна и должна превращаться в любую другую форму движения».[12]
2.2.1. ОСНОВНЫЕ ФОРМУЛИРОВКИ
· Закон сохранения энергии: невозможно возникновение и уничтожение энергии; во всех явлениях природы энергия переходит из одной формы в другую; причем в строго эквивалентных количествах.
Этот закон можно отразить формулой:
Еполн=const. (2.10)
Здесь Еполн - полная энергия всей системы.
· Невозможно создание вечного двигателя первого рода (устройство, позволяющее получать полезную работу, не привлекая на это энергию из окружающей среды). Иногда эту формулировку называют «принцип невозможности вечного двигателя первого рода».
· Аналитическое (математическое) выражение закона:
dQ = dU + dW (2.11)
где: Q–теплота, U –внутренняя энергия, W – полная работа.
Запись аналитического выражения первого закона термодинамики подчеркивает, что внутренняя энергия является функцией состояния, а работа и теплота таковыми не являются.
Физический смысл первого закона термодинамики наглядно раскрывает следующая формулировка: невозможно существование какого-либо устройства, способного производить работу, если в системе отсутствуют другие взаимосвязанные изменения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.