На практике удобнее пользоваться уравнениями, записанными для приращений функций. Чтобы перейти, например к уравнению, выражающему приращение энергии Гиббса, запишем уравнение (2.67) для двух состояний системы, т.е. для G1 и G2. Потом из уравнения для конечного состояния вычтем уравнение для начального состояния. Итоговое соотношение для приращений G и H . будет иметь вид:
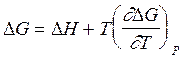 (2.68)
(2.68)
Уравнения Гиббса -Гельмгольца часто используют, заменяя термодинамическую функцию работой, т.е.
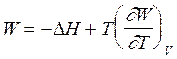 (2.69)
(2.69)
Соотношения между физико-химическими свойствами
системы и термодинамическими параметрами
Термодинамические функции по сути их вывода можно рассматривать как эквиваленты полезной работы, которую выполняет система в конкретных условиях опытов. С учетом этого, а также того, что они являются характеристическими функциями, т.е. позволяют вывести любые термодинамические уравнения, термодинамические функции применяют для связывания различных, определяемых экспериментально, физико - химических свойств системы с термодинамическими параметрами. Полученные соотношения используются в практических расчетах.
Среди химических свойств можно назвать
такие как: растворимость вещества, электрические характеристики и др. Например,
работу гальванического элемента (Wэ)
часто представляют выражением ![]() .
Здесь e-
физико-химическая характеристика, напряжение гальванического элемента, равное
предельному значению разности электродных потенциалов элемента (
.
Здесь e-
физико-химическая характеристика, напряжение гальванического элемента, равное
предельному значению разности электродных потенциалов элемента (![]() ) при токе, стремящемся к
нулю. Вместе с тем, работа при постоянных давлении и температуре связана с
энергией Гиббса соотношением: Wэ
= - D G.
Отсюда вытекает связь энергии Гиббса с напряжением гальванического элемента:
- D G
= nFe.
) при токе, стремящемся к
нулю. Вместе с тем, работа при постоянных давлении и температуре связана с
энергией Гиббса соотношением: Wэ
= - D G.
Отсюда вытекает связь энергии Гиббса с напряжением гальванического элемента:
- D G
= nFe.
Химическийпотенциал
Ранее речь шла главным образом о процессах, при которых количество вещества не изменялось. Между тем, в результате любой химической реакции эти изменения происходят. Оценивать такие изменения удобно с помощью понятия о химических потенциалах.
Пусть протекает реакция, которую можно представить стехиометрическим уравнением:
a1A1 + a2A2 +¼ + anAn = b1B1 + b2B2 + ¼ + bnBn (2.70)
Число молей вещества, входящих в систему переменно. При этом внутренняя энергия системы меняется.
В общем случае величина любой термодинамической функции зависит от параметров состояния реакционной системы, т.е. от p, V, Tиni. Например, значение энергии Гиббса меняется не только с изменением величин pи T , но и от изменения количества любого реагента. Поэтому можно записать:
G = f(p, T, nA1¼nAn, nB1¼nBn) (2.71)
Изменение энергии Гиббса с учетом выражения (2.71) будет иметь вид:
 (2.72)
(2.72)
Здесь индексы при частных производных n(A, B) показывают постоянство концентраций любых веществ (А, В). Индексыn(Aj, Bj) указывают на постоянство концентраций любых веществ (А, В), кроме веществ (Aj, Bj). Частные производные по отдельным реагентам представляют собой вклад в общее изменение энергии Гиббса связанное с изменением в ходе реакции количества данного реагента. Эти производные обозначают символом m и называют химическим потенциалом вещества i.
В терминах m и с учетом уравнений (2.57), (2.66) последнее выражение можно представить следующим образом:
dG = Vdp - SdT + Smi dni (2.73)
Несложно показать, что член Smi dni войдет в аналогичные соотношения для полных дифференциалов других термодинамических функций.
dU = TdS - pdV +Smi dni
dH = TdS +Vdp + Smi dni (2.74)
dA = -pdV - SdT + Smi dni
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.