Теплоемкость идеального газа не зависит от температуры. Ее принимают равной 1,5 R для одноатомного газа и 2,5 R для двухатомного газа.
Для получения формулы, приемлемой для практических расчетов уравнение (2.31) надо проинтегрировать с учетом температурных зависимостей отдельных членов.
При интегрировании в узком диапазоне температур (несколько десятков градусов) теплоемкости отдельных веществ можно усреднить, считая их, а также величины DCpпостоянными. В этом случае имеем:
DH(T2)-
DH(T1)
= DCp 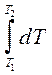 (2.35)
(2.35)
DH(T2) =DH(T1) + DCp (T2 -T1) (2.36)
Для оценки теплового эффекта при температуре (Т2) необходимо знать величины теплоемкостей реагирующих веществ а также тепловой эффект реакции при некоторой начальной температуре (Т1). Проблема снимается тем, что теплоемкости для большинства веществ приводятся в справочниках, а значение DH(T1) можно посчитать для температуры 298 К, на основе закона Гесса, пользуясь справочными данными для теплот образования реагирующих веществ (см. уравнение 2.24).
Типовые примеры
1. Чему равно изменение энтальпии 1 моля воды при переходе из жидкого состояния при 20 °С в лед с температурой 0 °С (давление примите равным 101325 Па, теплоту плавления – 6 кДж/моль) и Ср = 75,5 Дж/моль×К?
Решение
Образование льда в рассмотренном случае проходит через две стадии: охлаждение воды и собственно кристаллизация. Поэтому изменение энтальпии следует представить алгебраической суммой
DH = DHт + DHфп
где: DHт - изменение энтальпии при охлаждении системы до 0 °С; Hфп – изменение энтальпии при равновесном фазовом переходе.
Величину DHт нетрудно определить из формулы DHт = Ср(Т2 – Т1). Она равна 1,51 кДж/моль, Hфп равна по абсолютной величине теплоте фазового перехода, т.е. 6 кДж/моль.
На обоих стадиях процесса система отдает энергию поэтому значения DHт и DHфп отрицательны и в сумме дают – 7,51 кДж/моль.
2. Дана реакция: Н2S (г) +3/2О2 (г) ® H2О(г) + SO2(г)
Найдите: 1) DH° и DU° при 25 С 2) DH° при 1000 °K
Решение.
а) Расчет DH° выполняем на основе уравнения (2.24) и справочных данных по теплотам образования реагентов из простых веществ (см. табл. 2.6).
DH°(298)= -241,84 – 296,9 –(-20,15) –0 = - 518,59 кДж
Для вычисления DU° воспользуемся формулой (2.27):
DU°(298) = DH°(298) –RT (Dn)г = -518,59 – 8,31×298×(-0,5) 10-3 = -517,34 кДж
б) Расчет теплового эффекта при 1000 °K выполняем на основе уравнений (2.34) и (2.36). Поскольку, по определению, теплоемкости представляют собой тепловые эффекты отнесенные к одному градусу, расчет величины DСр можно выполнить на основе следствия из закона Гесса (2.24). Это с учетом приведенных в таблице 2.6 данных по теплоемкостям приведет к следующему выражению для DСр:
DСр = - 0,52 +1,34×10-3 Т – 1,46 ×10-7 Т2 + 0, 49×10-9(Т3 кДж
Для DH°(1000) имеем в соответствии с правилами интегрирования:
DH°(1000)
= DH°(298)
+ ![]() -518,59 – 0,52 ×10-3
(1000-298) +
-518,59 – 0,52 ×10-3
(1000-298) +
+0,67×10-6 (10002 -2982) – 0,49 ×10-10(10003 –2983) + 0,12×10-12(10004 –2984) = -512,91 кДж
3. Рассчитайте работу расширения газа для реакции спиртового брожения глюкозы при 25C:
а) в закрытом сосуде; б) в открытом сосуде.
Решение
Протекает реакция C6H12O6 (aq) = 2C2H5OН (aq) + 2CO2 (газ)
Образующийся газ производит работу - PDV . Принимая, что газ идеальный и пренебрегая начальным объемом системы, можно получить, что PDV @PV(газ) @nRT.
Отсюда следует, что:
а) в закрытом сосуде
W = - PDV = 0 (так как сосуд закрыт и газ не может расширяться);
б) в открытом сосуде
W = - PDV = - n(СО2)RT = 2´8,31Дж/К·моль ´ 298 К = 4,953 кДж
КОНТРОЛЬНОЕ ЗАДАНИЕ И ВОПРОСЫ
Выберите и обоснуйте правильное утверждение.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.