Иметь представление
- о предмете органической химии(неорганические и органические вещества; органогенные и биогенные элементы и их валентности, об особенностях строения атома углерода);
- об основных положениях теории строения органических соединения А.М. Бутлерова с современных позиций;
- о двух моделях строения атома – планетарной (ПМ) и квантово – механической (КММ), понятиях «орбита» и «орбиталь»;
- о видах химической связи (ионная, ковалентная, донорно-акцепторная, водородная);
- о вариантах разрыва ковалентной связи (гетеро- и гомолитической);
- об электроотрицательности элементов;
- об эффектах сопряжения (π─ π и р─ π);
- об изомерии органических соединений, - химическая; электронная; пространственная (цис – транс, конформационная, оптическая)
Знать
- теорию гибридизации атомных орбиталей (АО → ГАО) и величины валентных углов между гибридными орбиталями (ГАО) в sp3-, sp2-, sp- состояниях атома;
- как и какими орбиталями образуются сигма-связь (σ) и пи-связь (π), кратные связи между атомами;
- индуктивные (+I и –I) и мезомерные (+М и –М) эффекты влияния атомов друг на друга;
- шесть типов органических реакций (замещения, отщепления, присоединения, изомеризации, синтез, расщепление);
- электрофильные и нуклеофильные реагенты (частицы);
- механизмы химических реакций (свободно – радикальный, электрофильный и нуклеофильные);
- три стадии цепных реакций.
Уметь
- писать структурные формулы (развернутые, компактные, условные, обобщенные);
- по структурной формуле органического соединения определять тип гибридизации орбиталей каждого атома и строить геометрическую модель молекулы (или её каркаса);
- на основе знаний о структуре молекулы и о характере влияния друг на друга её атомов, прогнозировать химические свойства данного вещества (кислотно – основные, склонность к замещению, отщеплению, присоединению и т.д.)
Указания к выполнению заданий из Раздела 1: графические построения выполняются простым карандашом с использованием линейки. Размеры моделей молекул, орбиталей и др. графических объектов должны быть порядка (2-5)см ´ (10-15)см. Все сигма-связи (σ) и пи-связи (π) отображаются графически, а также под рисунком модели указывается их число, виды и области перекрывания электронных орбиталей .
Пример: 2 σ(sp3 – sp2) – лобовое перекрывание орбиталей (т.е. на оси, связывающей ядра атомов) или π(pz - pz) – боковое перекрывание орбиталей.
Тема 1. Строение молекул органических веществ.
Задания к теме 1.
1. Какие из приведенных соединений относятся к органическим: СО2; Na2CO3; CH3NHCH3; C2H5OH; CH3COONa; CaC2; Na2C2O4; CS2; H2N-(CO) – NH2?
2. Какие из приведенных соединений относятся к неорганическим?
СО2; Na2CO3; CH3NHCH3; C2H5OH; CH3COONa; CaC2; Na2C2O4; CS2; H2N-(CO) – NH2;CS2.
3. Что является критерием деления веществ на органические и неорганические?
4. Что является причиной многообразия органических веществ?
5. Укажите различия в основных положениях современной теории химического строения органических веществ и в ХIХв.
6. От чего зависят свойства каждого атома в молекуле органического вещества?
7. Какое из положений теории А.М. Бутлерова объясняет различие в реакциях
соединений одинакового состава:
2CH3-CH2-O-H + 2Na ® 2CH3-CH2-O-Na+ + H2
CH3-O-CH3 + Na ® реакция не идет
Свойства веществ определяются не только каественным и количественным составом, но и порядком соединения атомов в молекуле, т.е хим.строением.
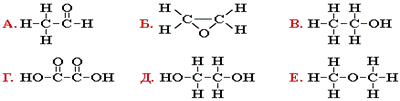 8. Какие соединения называются изомерами,
какие гомологами?
8. Какие соединения называются изомерами,
какие гомологами?
9. Какие из
данных соединений являются изомерами?
10. Что такое электронная орбиталь?
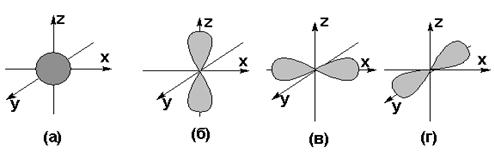
11. Укажите типы орбиталей (в) и (г):
12. Укажите типы орбиталей (а) и (б):
s – Орбиталь может быть ориентирована в пространстве единственным способом, так как имеет форму шара.
р-Орбиталь (формы гантели) может ориентированная вдоль оси Z и что р- подуровень состоит из трёх орбиталей – рх, ру и рz
Тема 2.Основные определения.
Задания к теме 2.
1. Что такое электроотрицательность атома? Пользуясь таблицей электроотрицательностей элементов (см. таблицу электроотрицательностей) определите, в каком порядке будут располагаться по своей полярности связи С-Н, С-F, O-H, N-H. Укажите, какой из элементов в этих связях будет положительным, а какой отрицательным?
2. Как изменяется электроотрицательность элементов в Периодической системе – в периоде?
3. Как изменяется электроотрицательность элементов в Периодической системе – в группе?
4.
Укажите соединения, в которых имеются только ковалентные связи:
СН4; CH3NH2; MgF2;
Na2C2O4; CH3ОNa.
КОВАЛEНТНАЯ СВЯЗЬ- тип химической связи, характеризуемый увеличением электронной плотности в области между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в своб. атомах
5. Укажите соединения, в которых имеются ионные и ковалентные связи: CH3COONa;CF4; MgF2; CH3ОNa; Na2C2O4; СН4.
6. Укажите молекулу с наиболее полярными связями: CH4; CF4; CCl4; CH3-O-CH3; CBr4; CS2.
7. Какие электроны участвуют в образовании ковалентной связи?
8. Какая орбиталь назывется молекулярной? На примере молекулы Н2 укажите
связывающие и разрыхляющие орбитали.
9. Какие основные свойства углерода
используют при написании структурных формул? Почему структурные формулы также
называют формулами строения? Какая связь называется сигма-связью
(s - связью) ? Почему ее называют
структурообразующей? Какие типы электронных орбиталей могут участвовать в ее
образовании?
10. Какая связь называется пи-связью (p-связью)? Какого типа орбитали образуют p-связь?
11. Как происходит гибридизация электронных орбиталей? В чем заключается переход атома углерода в “
возбужденное” состояние?
12. Что представляет собой sp3-гибридизация для элементов 2-го
периода?
13. Какая схема соответствует sp2-гибридизации углерода? Понятие
ароматичности для циклических ненасыщенных соединений. Правило Хюккеля.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.