Электроотрица́тельность — величина, характеризующая способность атомов поляризовать ковалентную связь. Двухатомная молекула из атомов с разной электроотрицательностью поляризуется так, что отрицательный полюс оказывается со стороны атома с большей электроотрицательностью, причём дипольный момент тем больше, чем больше разница электроотрицательностей.
|
Электроотрицательность химических элементов |
|||||||||||||||||
|
H |
He |
||||||||||||||||
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
||||||||||
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
|||||||
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
||||
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||||
В периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падение.
Разность величин относительных электроотрицательностей соседних атомов в соединениях позволяет судить о полярности химической связи между ними.
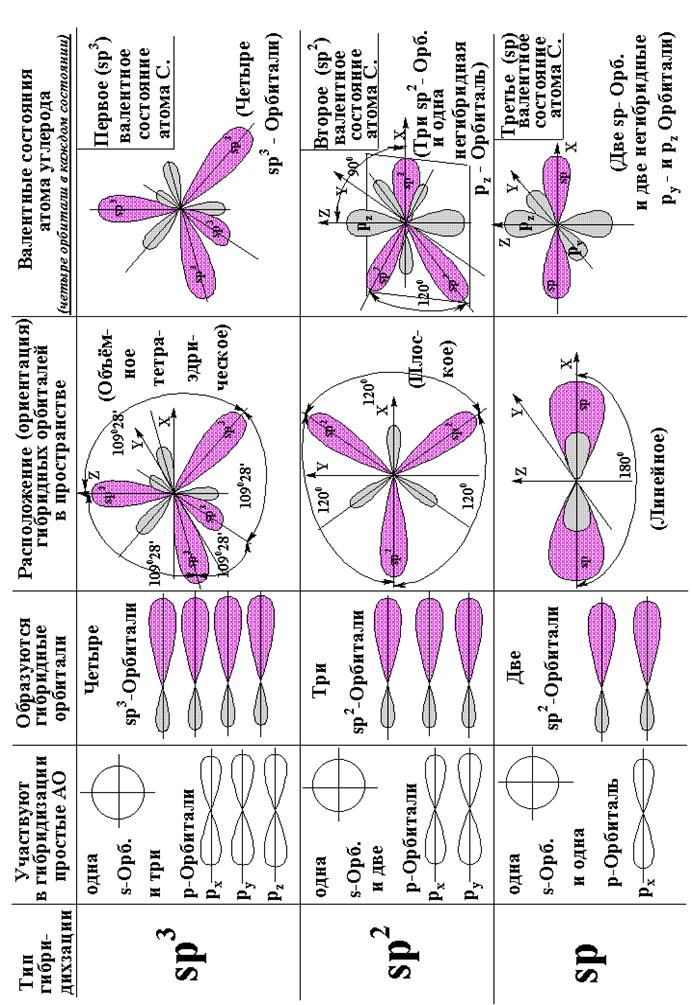 |
Номенклатура. Приложение 3.
Алканы (метан и его гомологи) имеют общую формулу CnH2n+2. Первые четыре углеводорода называют метан, этан, пропан, бутан. Далее названия членов этого ряда состоят из корня – греческого числительного и суффикса -ан.
Названия греческих числительных и соответствующие названия алканов.
|
Число |
Греческое числи-тельное |
Название алкана |
Число |
Греческое числи-тельное |
Название алкана |
Число |
Греческое числи-тельное |
Название алкана |
Число |
Греческое числи-тельное |
Название алкана |
|
1 |
моно |
метан |
4 |
тетра |
бутан |
7 |
гепта |
гептан |
10 |
дека |
декан |
|
2 |
ди |
этан |
5 |
пента |
пентан |
8 |
окта |
октан |
11 |
ундека |
ундекан |
|
3 |
три |
пропан |
6 |
гекса |
гексан |
9 |
нона |
нонан |
12 |
додека |
додекан |
Названия алканов положены в основу номенклатуры IUPAC.
Правила систематической номенклатуры:
1. Правило главной цепи. Главную цепочку, состоящую из атомов углерода, выбирают так, чтобы в ней было: а) максимальное число функциональных заместителей; б) максимальное число кратных связей; в) максимальная длинна; г) максимальное число боковых углеводородных групп.
2. Правило наименьших «адресов». Главную цепь нумеруют со стороны старшей функциональной группы от одного конца до другого арабскими цифрами. Каждый заместитель получает номер того атома углерода главной цепи, к которому он присоединен. Последовательность «адресов» (нумерации) выбирают таким образом, чтобы сумма «адресов» заместителей была наименьшей. Так же проводят нумерацию моноциклических соединений.
3. Правило радикалов. Названия радикалов – в окончании -ил. Все углеводородные боковые группы считаются одновалентными (односвязными) радикалами. Если боковой радикал сам содержит боковые цепи, то в нем по приведенным выше правилам выбирается дополнительная главная цепь, которая нумеруется, начиная с атома углерода, присоединенного к главной цепи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.