Теплоемкость и энтальпию газовой смеси определяли по правилу аддитивности (y– мольная доля компонента) [30]:
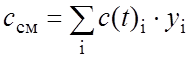 (2.8)
(2.8)
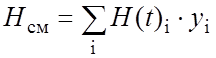 (2.9)
(2.9)
3) вязкость и теплопроводность газов
Вязкость m (Па×с) и теплопроводность l (Вт/(м×К)) газов при повышенном давлении удобно определять следующим образом [59]:
m = m0 + mр (2.10)
l = l0 + lр (2.11)
где m0 и l0 – вязкость и теплопроводность при данной температуре, mр и lр – поправки на давление. Зависимость m0 и l0 от температуры получали аппроксимацией полиномами 2-й степени данных из [74,82]:
m0 = f(t) l0 = f(t)
Поправку mр вычисляли по методу Джосси-Стила-Тодоса, lр – по методу Стила-Тодоса [59]. В этих методах mр и lр являются функциями приведенной плотности (последняя зависит от Р и t процесса). Для расчета необходимо знать критические параметры веществ. Математический аппарат можно смотреть в [59]. Сравнение расчетных значений с практическими данными из [56,59,74,82] показывает, что погрешность составляет 1-4 %.
Вязкость mсм газовой смеси определяли по правилу Вильке [59] (формулы (1,2) Приложения III), теплопроводность смеси lсм – по методу Линдсея-Бромли (формулы (3-6) Приложения III):
4) плотность
Плотность газовой смеси rсм при повышенном давлении рассчитывали по правилу аддитивности:
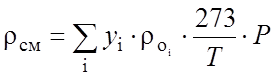 (2.12) Зависимость плотностей жидких воды и метанола получали аппроксимацией
полиномами 2-й степени практических данных из [51]:
(2.12) Зависимость плотностей жидких воды и метанола получали аппроксимацией
полиномами 2-й степени практических данных из [51]:
rв = f(t) rм = f(t)
5) давление насыщенных паров
Зависимость давления насыщенных паров воды от температуры получали аппроксимацией полиномом 2-й степени данных из [56]:
Рнп,в = f(t)
Таким образом, зависимости свойств веществ и их смесей от температуры и давления мы выразили в виде полиномов различных степеней, что очень удобно при реализации математической модели на ЭВМ.
2.4. Моделирование физико-химических процессов.
В основе рассматриваемого комплексного производства лежат процессы, связанные с протеканием химических реакций, поэтому их формальное описание является неотъемлемой частью модели. Также требуют рассмотрения процессы конденсации, т.к. они протекают совместно с процессами теплообмена. Последним уделено наибольшее внимание, а особенно утилизации тепла экзотермических реакций синтеза метанола.
2.4.1. Химические реакции.
В комплексном производстве аммиака и метанола протекают следующие реакции:
1) первичный риформинг метана
СН4 + Н2О « 3Н2 + СО, DН = 206,4 кДж (2.13)
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж (2.14)
СnHm + nН2О « nCO + (2n + m)/2 H2, DН > 0 (2.15)
Гомологи метана реагируют по реакциям (2.15) до конца [74].
2) вторичный риформинг метана
О2 + 2Н2 « 2Н2О, DН = - 241,7 (2.16)
СН4 + Н2О « 3Н2 + СО, DН = 206,4 кДж
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж
В соответствии с рекомендациями из [74] мы полагали, что сначала протекает реакция (2.16), причем кислород сгорает только с водородом, т.к. константа скорости реакции горения Н2 значительно больше, чем СО и СН4.
3) конверсия СО
СО + Н2О « Н2 + СО2, DН = - 41,2 кДж
Процесс осуществляется в две стадии, отличающиеся температурой проведения реакции [77].
4) очистка газа
Эта стадия включает в себя очистку от СО2 раствором моноэтаноламина согласно реакций (2.17,2.18) и тонкую очистку от СО и СО2 методом метанирования по реакциям (2.19,2.20).
CO2 + 2RNH2 + H2O « (RNH3)2CO3 (2.17)
CO2 + (RNH3)2CO3 + H2O « 2RNH3HCO3 (2.18)
СО + 3Н2 « СН4 + Н2О, DН < 0 (2.19) СО2 + 4Н2 « СН4 + 2Н2О, DН < 0 (2.20)
В балансовых расчетах количество СО2, поглощенного раствором МЭА, вычисляли по равновесному давлению СО2 над раствором МЭА на выходе газовой смеси из абсорбера. Равновесное давление СО2 зависит от температуры, концентрации раствора МЭА и степени карбонизации глубокорегенерированного потока [74]. Аналитические зависимости, предложенные в [49], не дают удовлетворительных результатов, поэтому мы использовали практические данные, приведенные в [74]. В балансовых расчетов растворимостью газов в МЭА-растворе пренебрегли согласно [19]. Согласно [74] мы полагали, что реакции (2.19,2.20) необратимы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.