2) описание различных процессов (физические, химические, механические и др.), протекающих на различных стадиях ХТЭС, также с помощью математических уравнений;
3) расчет для каждой подсистемы материального и теплового балансов, т.е. обеспечение соблюдения законов сохранения на каждой стадии производства;
4) проведение поверочного расчета для нового оборудования исходя из определенных на уровне 3 нагрузок на аппараты;
5) объединение отдельных подсистем в систему, при этом между ними возникает большое число связей, обусловленных движением материальных и тепловых потоков от одного аппарата к другому. Другими словами, необходимо отразить в модели обмен веществом и энергией между стадиями производства, основываясь на законах сохранения;
6) вывод общих параметров ХТЭС и расчет экономических показателей.
Каждый следующий уровень описания ХТЭС наследует существенные свойства предыдущего уровня.
На рис. 9 приведена соответствующая структурная схема, отражающая построение модели ХТЭС как бы ''по вертикали''.
Построение модели ''по горизонтали'' отражено на рис. 10, где указаны основные расчетные блоки модели и связи между ними.
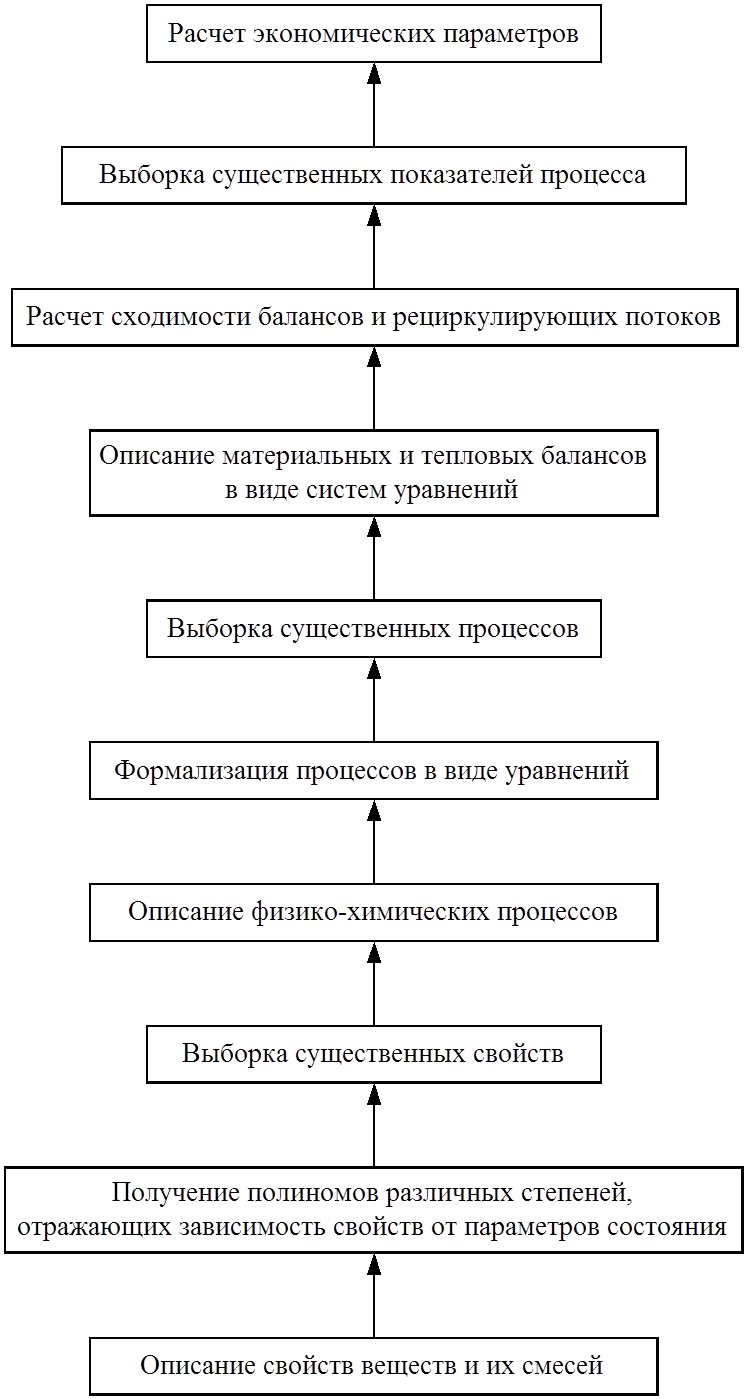
Рис. 9. Структурная схема построения модели ХТЭС ''по вертикали''.
На рис. 10 приняты следующие условные обозначения: V – объемный расход, G – массовый расход, Ni – состав потока, t – температура, Р – давление, N – мощность. В штриховых прямоугольниках указаны параметры, которые должны быть заданы, остальные параметры являются расчетными.
Данная структурная схема является ''ядром'' модели, на ней указаны лишь основные расчетные блоки и связи между ними. Далее будет показано, что необходимо провести еще ряд поверочных расчетов с целью определения существенности влияния того или иного физико-химического процесса (например, растворение газов), расчеты аппаратов на прочность и др.
На схеме также указаны точки ''разрыва'' замкнутых рециркулирующих потоков. Это сделано для того, чтобы система стала разомкнутой. Более подробно данный вопрос обсуждается в разделе 2.6.
Следующие разделы данной Главы посвящены формализации объекта исследования. В них приведен математический аппарат, описывающий каждую подсистему согласно принятой структуре. Кроме того, критически оцениваются все принятые допущения и на каждом уровне описания определяются существенные свойства ХТЭС.
2.3. Моделирование свойств веществ и их смесей.
Для моделирования физико-химических процессов необходимо задать свойства веществ, их зависимость от температуры и давления, а также определить правила и уравнения для вычисления свойств смесей. Приступим к описанию свойств веществ:
1) характеристики индивидуального вещества: критические параметры (температура Тс, давление Рс, объем Vc, коэффициент сжимаемости Zc), температура кипения Тb (при давлении 1 атм), молярная масса М, фактор ацентричности Питцера w - все данные взяты из [59].
2) теплоемкость и энтальпия
Зависимость удельной изобарной теплоемкости газа cp (Дж/(моль×К)) от температуры T (К) описали полиномом 3-й степени с коэффициентами из [59] (начальная точка – 1 атм, 298 К):
cp = a + bT + cT2 + dT3 (2.1)
Зависимость знтальпии газа от температуры можно найти, проинтегрировав уравнение Кирхгофа [30]:
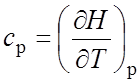
Выражение (2.1) интегрировали в пределах от 298 до t+273:
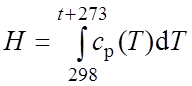 (2.2)
(2.2)
Таким образом получали зависимость удельной энтальпии (Дж/моль) от температуры (°С) в виде полинома четвертой степени для каждого компонента газовой смеси:
Н = f(t) (2.3)
Тот факт, что энтальпия (теплоемкость) газа зависит от давления, можно математически выразить следующим образом:
Н = f(t) + Н'(P,t)
где Н'(P,t) – поправка на давление, зависящая как собственно от давления, так и от температуры. Причем при Р = const Н' слабо зависит от температуры. Например, при расчете по методу Ли-Кеслера [59] для метанола при Р = 10 атм и t = 240…300 °С Н' = -828…-615 Дж/моль, что составляет не более 3% от величины Н. На всех рассматриваемых нами стадиях ХТЭС давление изменяется незначительно (не более 2 атм), т.е. можно полагать Р » const и Н ' » const. Тогда все поправки на давление, входящие в левую и правую части уравнения теплового баланса, взаимно сократятся. Таким образом, можно не учитывать влияние давления на энтальпию (теплоемкость) газов, что не приведет к большим погрешностям.
Зависимость удельной энтальпии Н (кДж/кг) перегретого водяного пара от температуры t (°С) и давления Р (атм), удельной энтальпии насыщенного водяного пара и водяного конденсата от температуры получили аппроксимацией табличных данных из [57]:
Нп.п. = f(Р,t) (2.4)
Нн.п. = f(t) (2.5)
Нв.к. = f(t) (2.6)
Также аппроксимацией табличных данных из [82] получили зависимость теплоты конденсации метанола от температуры:
Нконд.м. = f(t) (2.7)
Уравнения (2.4-2.6) являются полиномами различных степеней.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.