где ρ – относительная плотность газа; уН2S – мольное содержание Н2S в газе , %.
При содержании СО2 и Н2S до 25% каждого псевдокритические параметры определяют по приближенным формулам:
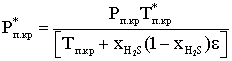 ;
(2.3.10)
;
(2.3.10)
![]() (2.3.11)
(2.3.11)
![]() (2.3.12)
(2.3.12)
где ХН2S , НCO2 – мольные доли сероводорода и двуокиси углерода, Рпс кр и Тпс кр – определяются по принципу аддитивности для смесей газа.
2.4. Уравнения состояния. Коэффициент сверхсжимаемости. Фактор ацентричности.
Зависимость между давлением, объемом и температурой называется уравнением состояния.
Двухпараметрические уравнения состояния.
Наиболее распространенными в технологии газовой промышленности является уравнение Менделеева – Клайперона, которое с учетом реальных свойств газа имеет вид:
PV=ZRT (2.4.1)
где Р – давление, Па; V – объем одного моля, м3; R – удельная газовая постоянная, Дж/кгК R=8314 Дж/мольК; Т – температура, К; Z – коэффициент сверхсжимаемости газа, учитывающий реальные свойства газа, т.е. взаимодействие молекул, их размеры.
Для определения коэффициента сверхсжимаемости пользуются универсальными графиками (графики Брауна и Катца), которые составлены в зависимости от приведенных давлений и температур. Для смесей газов в качестве критических применяются псевдокритические давления и псевдокритические температуры. Для более точного учета реальных свойств Ван-дер-Ваальс в 1979 году предложил следующий вид уравнения состояния
(Р+а/V2)∙(V–b)=RT (2.4.2)
которое учитывает взаимодействие молекул – коэффициент a, также собственный объем молекул – коэффициент b. Коэффициенты найдены с использованием соотношения для критического состояния вещества
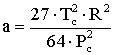 ;
;
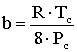 (2.4.3)
(2.4.3)
При преобразовании уравнения Ван-дер-Ваальса через удельный объем получается кубическое уравнение, при введении коэффициента сверхсжимаемости уравнение также принимает кубическую форму.
В газовой промышленности для расчета ряда технологических процессов используется уравнение Редлиха-Квонга, которое является дальнейшей модификацией уравнения Ван-дер-Ваальса. Оно имеет вид:
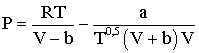 (2.4.4)
(2.4.4)
Для многокомпонентных смесей значения а и b равны:
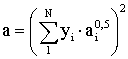 (2.4.5)
(2.4.5)
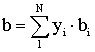 (2.4.6)
(2.4.6)
где N – число компонентов, уi – мольная доля i –го компонента.
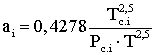 (2.4.7)
(2.4.7)
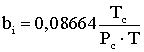 (2.4.8)
(2.4.8)
Для расчета коэффициента сверхсжимаемости природного газа уравнение Редлиха-Квонга приводится к виду:
Z3–Z2+Z∙(а+b2∙Р–b)∙Р–а∙b∙Р2=0 (2.4.9)
Значение Z определяется с ошибкой не более 2% при 0,01<Рпр<12 и 1,05<Тпр<1,6.
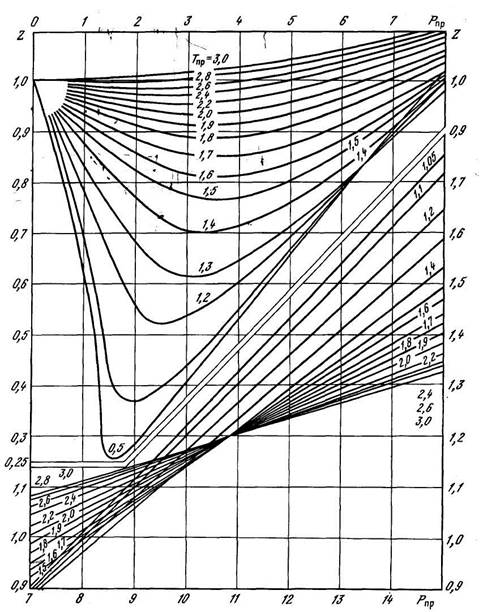
Рисунок 2.4.1 – Зависимость коэффициента сверхсжимаемости Z природного газа от приведенных давления и температуры.
Значение коэффициента сверхсжимаемости Z по графику определяется для природных газов, содержащих не более 2% высококипящих и ароматических углеводородов каждого и кислых компонентов не более 5% (см. рисунки 2.4.2÷2.4.4).
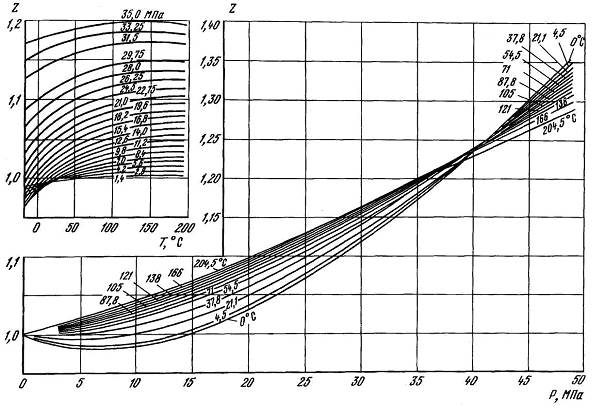
Рисунок 2.4.2 – Зависимость коэффициента сверхсжимаемости Z азота от давления и температуры.
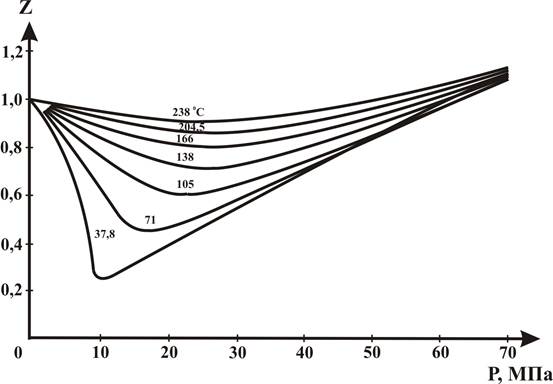
Рисунок 2.4.3 – Зависимость коэффициента сверхсжимаемости Z углекислого газа от давления и температуры.
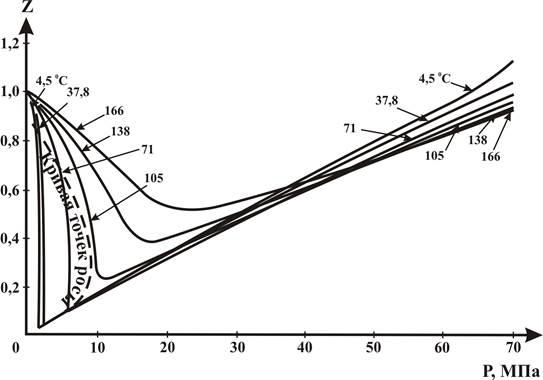
Рисунок 2.4.4 – Зависимость коэффициента сверхсжимаемости Zсероводорода от давления и температуры.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.