Зона 3 представляет термодинамические условия, в которых существуют нефтяные месторождения. Для условий выше линии однофазных, недонасыщенная нефть, ниже – газонефтяные месторождения.
2.9.3. Правило фаз Гиббса.
Качественная характеристика фазового состояния может быть определена с использованием правила фаз Гиббса. Оно выражается в виде следующей формулы:
F=C–P+q (2.9.7)
где F – число степеней свободы; С – число компонентов смеси; Р – число присутствующих фаз.
Например, для однокомпонентной системы С=1 при двухфазности Р=q число степеней свободы равно F=1. Это означает, что можно менять только один параметр или температуру, или давление. Для 3х фазной системы Р=3, значение F=0, т.е. нельзя изменять ни давление, ни температуру.
Правило фаз можно применять для многокомпонентных систем, представленных одной или несколькими фазами. Оно особенно ценно при прогнозе качественного поведения многокомпонентных систем, которое может быть в различных технологических процессах разработки и эксплуатации месторождений природных газов.
2.9.4. Понятие константы равновесия.
Качественный расчет двухфазных систем можно приближенно производить, зная или составы жидкой фазы, или газовой среды при равновесных условиях заданной температуры. Для возможности количественного расчета и учета влияния вводится понятие константа равновесия (коэффициент распределения).
Константа равновесия для идеальных газов определяется с использованием законов Дальтона-Рауля
![]() или
или
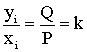 (2.9.8)
(2.9.8)
Константа равновесия есть отношение в равновесных условиях мольной доли i-го компонента в газе уi к мольной доли этого же компонента в жидкости хi.
У индивидуального углеводорода упругости паров для однокомпонентного состояния является только функций температуры. У смеси углеводородов упругость паров является функцией как температуры, так и общего давления, k.
Как показывает практика нахождение констант равновесия как отношение упругости паров к давлению смеси возможно только при невысоких давлениях в пределах 1÷1,5 мПа, температурах и для смеси легких алканов.
2.9.5. Уравнение фазовых концентраций.
Для решения качественного и количественного распределения компонентов смеси углеводородов в газовой и жидкой фазах пользуются уравнениями фазовых концентраций.
Пусть многокомпонентная двухфазная смесь углеводородов находится в замкнутом сосуде при равновесных давлении Рс и температуре Тс. Общее число молей всех компонентов – N, в жидкой фазе находится Nж молей, в газовой – Nг молей, т.е.:
![]() (2.9.9)
(2.9.9)
Состав всей смеси в мольных
долях 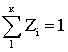 , Zi – мольная доля i-го компонента в смеси; к – число компонентов. yi и хi – мольные доли i-го компонента соответственно в газе
и жидкой фазе. Тогда можно написать для каждого компонента следующее равенство:
, Zi – мольная доля i-го компонента в смеси; к – число компонентов. yi и хi – мольные доли i-го компонента соответственно в газе
и жидкой фазе. Тогда можно написать для каждого компонента следующее равенство:
![]() (2.9.10)
(2.9.10)
или
![]() (2.9.11)
(2.9.11)
где V, L – мольные доли соответственно газовой и жидкой фаз, при этом
V+L=1 (2.9.12)
При подстановке в уравнение (2.9.11) значения константы равновесия кi, L или V из (2.9.12), то получим:
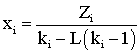 (2.9.13)
(2.9.13)
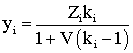 (2.9.14)
(2.9.14)
Полученные уравнения называются уравнениями фазовых концентраций.
При известных давлении, температуре, молярном составе смеси, константах равновесия уравнения фазовых концентраций позволяют определить концентрацию компонентов в фазах. Решение получается для одного моля исходной смеси, при известном общем количестве смеси можно найти количество газовой и жидкой фаз.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.