На основании этого было высказано предположение о существовании месторождений природных газов в гидратном состоянии. Рядом ученных – Ф.А. Требин, Н.В. Черский, А.А. Трофимух, В.Г. Васильев и Ю.Ф. Макогон было зарегистрировано в виде открытия о возможности существования газогидратных залежей. Это было в 1967 г., еще ранее в 1946 г. профессор И.Н. Стрижов высказал гипотезу о принципиальной возможности существования газогидратных месторождений на севере Тюменской области и Красноярского края, на севере Якутии, на территории Канады и Аляски толщины многолетнемерзлых пород изменяются от 0 до 1400 м.
На основе расчетов и исследований составлены графики, на которых показаны зависимости интервалов глубин зоны гидратообразования на суше и в акватории океана от температур для метана и газа плотностью 0,6.
СН4, 0,6 – линии равновесных условий гидратообразования (ниже и левее гидраты могут образовываться)
1 – район с умеренной ММП.
2 – район с большой толщиной ММП.
3 – район (акватория) океана с глубиной воды 2,5 км.
Ниже и левее этих линий гидраты не образуются (точнее больше указанных глубин нет температур, соответствующие гидратообразованию)
В России выявлено достаточно большое число площадей НГП, где возможно существование газогидратных залежей.
Из открытых месторождений газогидратными являются, хотя бы по косвенным признакам, Мессояхское месторождение. Эти признаки можно показать на графике.
Кроме того, состав газа изменяется. При разложении гидратов увеличивается в смеси СО2 и С2Н6, % мол. (например, СО2 – 0,38 до 0,61; С2Н6 – 0,013 до 0,055) в процессе разработки, при этом уменьшается N2+Не (0,779 до 0,280).
2.9. Фазовые превращения углеводородных систем.
2.9.1. Упругость насыщенных паров.
Насыщенный пар представляет двухфазную систему, в которой часть вещества находится в жидком, а другая часть в газообразном состоянии. Количественное соотношение жидкости и газа для двухфазной системы определяется давлением и температурой. Упругость или давление насыщенных паров можно назвать как давление, при котором двухфазная система находится в равновесии при данной температуре.
На диаграмме упругость пара – температура, приведенная на рисунке 2.9.1, из которого видно, что по мере роста температуры упругость пара или давление насыщенных паров увеличивается.
Причиной такого поведения системы является увеличение кинетической энергии молекул, находящихся в жидкости, что позволяет преодолеть силы сопротивления и молекуле перейти в газообразное состояние. По мере роста числа молекул в газообразном состоянии будет увеличиваться количество молекул, возвращающихся обратно в жидкость. В результате наступит динамическое равновесие, при котором число молекул, покидающих жидкость, будет равно количеству молекул, возвращающихся в нее из газообразного состояния. Давление в газе, при котором наступает равновесие, является давлением насыщенных паров или упругости паров.
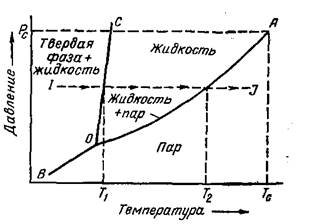
Рисунок 2.9.1 – Фазовая диаграмма “давление-температура” однокомпонентной системы.
Значение упругости насыщенных паров индивидуальных углеводородов можно определить по диаграммам Р-Т или рассчитать по формуле:
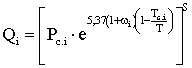 , мПа (2.9.1)
, мПа (2.9.1)
где Qi – давление насыщенных паров; S – эмпирический коэффициент, меняется для углеводородов парафинового ряда от 0,125 до 1.
Закон Дальтона гласит, что давление смеси газов равно сумме их парциальных давлений или
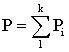 (2.9.2)
(2.9.2)
где Р – давление смеси газов; k – число компонентов смеси; Рi – парциальное давление.
Молекулярно-кинетическая теория идеальных газов объясняет этот закон, для реальных газов он применим приближенно при температурах и давлениях, далеких от критических значений.
Для смесей газов, находящихся в равновесии со своей жидкостью, можно записать
![]() (2.9.3)
(2.9.3)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.