Решение проводят методом
последовательных приближений (итерации), задавая последовательно значение –
мольную долю в газовой фазе до получения условия 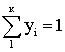 из
уравнения (2.9.14). При расчете жидкой фазы задаются последовательные значения L – мольная доля в жидкой фазе,
рассчитывают кi по (2.9.13) до выполнения
условия
из
уравнения (2.9.14). При расчете жидкой фазы задаются последовательные значения L – мольная доля в жидкой фазе,
рассчитывают кi по (2.9.13) до выполнения
условия 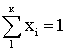 .
.
При решении используют методы хорд, касательных и Ньютона.
2.9.6. Определение констант фазового равновесия.
Константы фазового равновесия находят экспериментально или расчетным методом.
Константа фазового равновесия
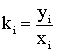 постоянна при фиксированных
температурах и давлениях лишь для идеальных растворов, когда они не зависят от
состава сосуществующих фаз. В этом случае константы называются идеальными,
очень часто их находят как отношение упругости паров к давлению
постоянна при фиксированных
температурах и давлениях лишь для идеальных растворов, когда они не зависят от
состава сосуществующих фаз. В этом случае константы называются идеальными,
очень часто их находят как отношение упругости паров к давлению ![]() .
.
Реальные константы фазового равновесия зависят от давления, температуры, состава углеводородных смесей. Составы природных углеводородных смесей, содержащихся в газоконденсатных и нефтяных месторождениях, весьма разнообразны.
Поэтому для конкретных смесей необходимо определять в каждом отдельном случае. Их находят или экспериментальным, или расчетным способами.
Экспериментально определяется
при помощи специальных сосудов высокого давления в изотермических условиях –
бомбах PVT, в которых можно в
определенном диапазоне поддерживать постоянным давление – объем – температуру.
Отбирают пробы жидкой и газовых фаз, находят компонентный состав 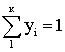 и
и 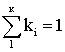 ,
далее рассчитывают ki. Расчетные методы можно
подразделить на два способа: расчетно-графический по давлению схождения и расчетный
с использованием уравнения состояния.
,
далее рассчитывают ki. Расчетные методы можно
подразделить на два способа: расчетно-графический по давлению схождения и расчетный
с использованием уравнения состояния.
Определение контакта фазового равновесия по давления схождения основан на том факте, что в многокомпонентных смесях константы равновесия сходятся к единице при критическом давлении и критической температуре. Если температура отличается от критической (обычно меньше критической), то давление, при котором константы равновесия сходятся к единице, называют давлением схождения. На рисунке 2.9.6 даны значения констант равновесия при температуре Т=…, давление схождения Рсх=… мПа.
Константа равновесия является функция давления, температуры, давления схождения. Экспериментально доказано, что константы равновесия компонентов, входящих в состав различных смесей, равны, если равны как давление схождения, так и давления и температуры.
Давление схождения определяют несколькими способами. В качестве примера предлагается способ, описанный в […]. Давление схождения зависит от компонентного состава обеих равновесных фаз, часто на практике определяется или составом исходной смеси, или составом жидкой фазы.
Для известных молекулярной массы Мс7+ и плотности ее dс7+ давление схождения Рсх равно:
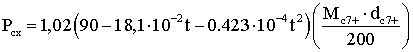 (2.9.15)
(2.9.15)
при 120≤Мс7+≤200
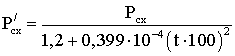 (2.9.16)
(2.9.16)
при 90≤Мс7+≤120
Если известны состав жидкой фазы, то давление схождение вычисляют по формуле:
![]() (2.9.17)
(2.9.17)
где 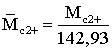 ;
; 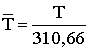 ;
а1=0,12258886; а2=1,225988; а3=–0,12539303; а4=1,1242308;
Т – в К; Мс7+ – средневзвешенная молекулярная масса с2+.
;
а1=0,12258886; а2=1,225988; а3=–0,12539303; а4=1,1242308;
Т – в К; Мс7+ – средневзвешенная молекулярная масса с2+.
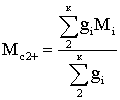 где gi – массовая доля i-го компонента в смеси; i – компоненты от С2Н6
и все более высококипящие.
где gi – массовая доля i-го компонента в смеси; i – компоненты от С2Н6
и все более высококипящие.
Определив давление схождения, константы равновесия находят по атласу констант Американской ассоциации газобензинового производства NGAA, или по таблицам констант равновесия СевКавНИИГаза.
В работе […] приводятся аппроксимационные зависимости констант равновесия от трех переменных давления схождения, давления и температуры. Ошибка при расчете констант равновесия по этим зависимостям от метана до изопентана составляет около 1%, а для более высококипящих вплоть до нормального гексадекана может доходить до 5%.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.