В газовой промышленности за стандарт приняты условия Т=293,15 0К и Р=0,1013 МПа, в этом случае 1 гмоль и 1 кгмоль будут занимать объемы соответственно 24,04 дм3/моль и 24,04 м3/кмоль.
Для природного газа, являющегося смесью углеводородных и неуглеводородных компонентов, вводится понятие кажущаяся молярная масса Мк, значение которой определяется по формуле
Мк=åМi∙ni кг/кмоль (2.1.1)
где Мi – молярная масса i-го компонента, кг/кмоль; ni - молярная масса i-го компонента в смеси; к – число компонентов в смеси.
Если ni дано в мольных процентах, формула имеет вид:
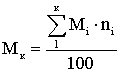 (2.1.2)
(2.1.2)
Иногда используют единицы измерения г/моль. Часто слово “кажущаяся” опускается и для природного газа это значение называют молярная (а иногда молекулярная) масса газа.
Плотность вещества – масса единицы объема. Плотность газа определяется, как отношение молярной массы к объему моля газа, т.е.
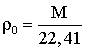 , кг/м3 (2.1.3)
, кг/м3 (2.1.3)
При стандартных условиях – ρст
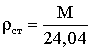 , кг/м3 (2.1.4)
, кг/м3 (2.1.4)
где ρ0 и ρст – плотность газа при соответствующих условиях.
2.2. Пересчет состава газа и конденсата.
Пересчет состава газа и конденсата осуществляется следующим образом.
Дан состав газа (конденсата) в мольных долях – ∑Мi=1, где ni – мольная масса i-го компонента в смеси, к – число компонентов в смеси. При известной молярной массе Мi – каждого компонента определить состав в массовых долях, т.е. найти mi и ∑mi=1, mi – массовая доля i-го компонента. Решение приводится в таблице 2.2.
Таблица 2.2 – Пересчет мольного состава смеси углеводородов в массовый.
|
Компоненты |
Мольные доли, ni |
Молярная масса, mi |
Масса i-го компонента |
Массовая доля |
|
1 |
n1 |
М1 |
n1∙ М1 |
|
|
2 |
n2 |
М2 |
n2∙М2 |
|
|
3 |
n3 |
М3 |
n3∙ М3 |
|
|
i |
ni |
Мi |
ni∙ Мi |
|
|
Итого |
1,00 |
– |
|
|
Пересчет массового состава в мольный приведен в таблице 2.3.
Таблица 2.3
|
Компоненты |
Мольные доли, ni |
Молярная масса, mi |
Масса i-го компонента |
Массовая доля |
|
1 |
m1 |
М1 |
m1/ М1 |
|
|
2 |
m2 |
М2 |
m2/М2 |
|
|
3 |
m3 |
М3 |
m3/ М3 |
|
|
i |
mi |
Мi |
mi /Мi |
|
|
Итого |
1,00 |
– |
|
|
Используя расчеты легко найти молярную массу смеси (кажущуюся молярную массу) – Мк по формуле (2.1.1) или по следующему выражению:
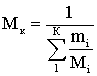 (2.2.1)
(2.2.1)
Содержание жидких углеводородов определяется по формулам:
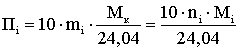 ,
г/м3 (2.2.2)
,
г/м3 (2.2.2)
где Пi – потенциальное содержание i-го компонента в смеси газа, г/м3 при 0,1013 МПа и 293 К.
Объем паров, получаемый после испарения жидкого углеводорода – Vi в м3, равен:
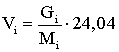 ,
м3 (2.2.3)
,
м3 (2.2.3)
где Gi – масса жидкого углеводорода при 0,1013 МПа и 293 К.
2.3. Критические параметры. Псевдокритические параметры. Приведенные параметры. Закон соответственных состояний.
Рассмотрим диаграмму давление-температура Р-Т для однокомпонентного вещества, приведенную на рисунке 2.3.1.
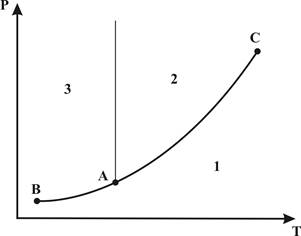
Рисунок 2.3.1 – Фазовая диаграмма “давление-температура” чистого вещества.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.