На диаграмме зона (1) соответствует газовому состоянию вещества, зона (2) – жидкости, зона (3) – твердому состоянию вещества. Линия АС – двухфазное, газожидкостное состояние; линия АВ – соответствует равновесию газа и твердого состояния вещества.
Точка А – соответствует тройной точке, в которой одновременно в равновесии могут быть газ, жидкость и твердое тело.
Тоска С – критическая точка, которой соответствует критическое состояние вещества – критическое давление и критическая температура, а также другие параметры (уд. объем, плотность и т.д.).
Критическое давление – это давление, выше которого вещество не может быть в жидком и газообразном состоянии одновременно (см. рисунок 2.3.1 на линии АС вещество в жидком и газообразном состоянии).
Критическая температура – это температура, выше которой газ не может быть переведен в жидкость при любом давлении. Можно дать и другое определение, что это температура, при которой кинетическая энергия становится равной потенциальной энергии притяжения молекул.
Проанализируем зависимость давления от удельного объема для различных температур, приведенном на рисунке 2.3.2, как и на предыдущем графике рассматривается однокомпонентный углеводород парафинового ряда.
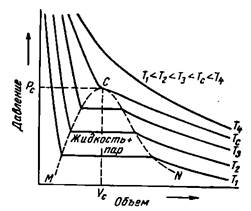
Рисунок 2.3.2 – Типичная диаграмма Р – V (давление – объем) для однокомпонентной системы с изображением нескольких изотерм.
Кривая (1) соответствует критической температуре, на этой кривой существует точка перегиба, в которой давление равно критическому, удельный объем тоже критический. Для этой точки можно записать:
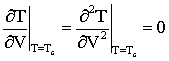 (2.3.1)
(2.3.1)
При критических давлениях и температурах все другие параметры, характеризующие вещество, являются критическими, например, критическая плотность, критический удельный объем и другие показатели.
Для унификации графиков и различных формул по определению параметров вводится понятие приведенные параметры, которые являются безразмерными и показывают во сколько раз действительные параметры состояния газа больше или меньше критических:
Рпр=Р/Рс; Тпр=Т/Тс ; Vпр=V/Vс ; ρпр=ρ/ρс и др.
где Р, Т, V, ρ – действительные параметры, давление, температура, удельный объем, плотность; Рс, Тс, Vс, ρс – критические параметры.
Такая унификация основана на принципе соответственных состояний, т.е. зависимости свойств различных веществ от безразмерных комплексов, приведенных параметров. Ван-дер-Ваальсом было показано, что соответственное состояние достигается в их критическом состоянии.
Для многокомпонентных веществ вводится понятие псевдокритических параметров, определяемых по принципу аддитивности. Например, псевдокритические давления Рпс кр и температура Тпс кр равны:
Рпс кр=∑ni∙Рсi (2.3.2)
Тпс кр=∑ni∙Тсi (2.3.3)
где ni – мольные доли i-го компонента в смеси.
Критические параметры С5+ или С6+ определяют по формулам:
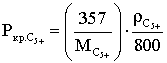 (2.3.4)
(2.3.4)
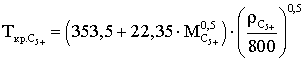 (2.3.5)
(2.3.5)
где МС5+(МС6+) и ρС5+ (ρС6+) – молекулярная масса и плотность компонентов С5+(С6+).
Формулы справедливы при 100≤Мс5+≤240 кг/кМоль и 700<ρс5+<950 кг/м3.
Псевдокритические параметры приближенно можно рассчитать при известной относительной плотности газа по формулам:
Рпс кр= (5,53–1,04∙ρ0,5), МПа (2.3.6)
Тпс кр=12+238∙ρ0,5 , К (2.3.7)
При наличии в составе природного газа сероводорода менее 5% по объему используют формулы:
Рпс кр=5,195–1,087∙ρ+0,0762∙уН2S , МПа (2.3.8)
Тпс кр=125,64+111∙ρ+1,97∙ уН2S , К (2.3.9)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.