где уi – мольная доля i-го компонента смеси газов, находящихся в равновесии со своей жидкостью.
В соответствии с законом Рауля для смесей газов, находящихся в равновесии со своей жидкостью, можно найти парциальное давление Рi при известных мольной концентрации i-го компонента в жидкости – хi и давления насыщенного пара i-го компонента при заданной температуре – Qi.
![]() (2.9.4)
(2.9.4)
Законы Дальтона-Рауля позволяют решать различные задачи приближенно по определению состава фаз, находящихся в равновесии.
Например, при известных температуре или давлении, при которых находится смесь газов в равновесии со своей жидкостью, по концентрации компонентов в данной фазе можно найти концентрацию компонентов в другой.
Имеем мольный состав в жидкой
фазе – 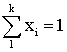 , где k – число компонентов смеси; хi – мольная концентрация i-го компонента в жидкой фазе. Упругость
насыщенных паров при заданной температуре по формуле (2.9.1) или графиком равно
Qi – для i-го компонента. Парциальное давление
, где k – число компонентов смеси; хi – мольная концентрация i-го компонента в жидкой фазе. Упругость
насыщенных паров при заданной температуре по формуле (2.9.1) или графиком равно
Qi – для i-го компонента. Парциальное давление ![]() , общее давление в смеси Р
определяется как сумма Рi,
т.е.
, общее давление в смеси Р
определяется как сумма Рi,
т.е. 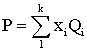 . Используя равенство (2.9.3) и
(2.9.4), находится равновесная концентрация i-го компонента в газовой фазе
. Используя равенство (2.9.3) и
(2.9.4), находится равновесная концентрация i-го компонента в газовой фазе
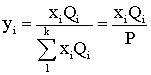 (2.9.5)
(2.9.5)
При известном составе
равновесной газовой фазы 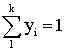 и заданной
температуре, равновесный состав жидкой фазы и давление смеси находят следующим
образом
и заданной
температуре, равновесный состав жидкой фазы и давление смеси находят следующим
образом
Так как 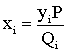 , то
, то 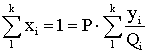 отсюда
отсюда
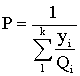 ,
, 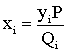 .
.
Полученные решения для многокомпонентных систем носят качественный характер, нельзя получить соотношение между жидкой и газовой фазами и рассчитать баланс продукции в технологических линиях и аппаратах.
Учет реальных свойств для более точного решения указанных задач предполагает введение таких понятий как летучесть и др.
2.9.2. Фазовые превращения.
Однокомпонентная система.
Фаза – это физически отдельная часть материи, имеющая одинаковые физические и химические свойства. Свойствами фазы являются интенсивность и экстенсивность. Интенсивность не зависит от суммарного количества вещества в системе, таковыми являются плотность, удельная теплоемкость, коэффициент теплопроводности и др. Экстенсивные свойства определяются количеством вещества, например, объем, масса и т.д.
Для изучения фазовых превращений однокомпонентных систем воспользуемся диаграммами давление – температура Р-Т и давление – удельный объем Р-V, приведенные на рисунках 2.9.1 и 2.9.2. На рисунке 2.9.1 показаны типичные фазовые состояния вещества. Точки А – соответствуют критические параметры, точка С – тройная точка, в которой одновременно в равновесном состоянии находится газ, жидкость и твердая фаза. При изотермическом повышении давления из т.1 до линии ОА фазовых превращений на происходит, в т.2 на линии ОА появляются капельки жидкости, при дальнейшем повышении давления весь газ переходит в жидкость. Точка 2 на линии ОА называется точкой конденсации, совокупность точек на линии ОА дает кривую точек конденсации. При изотермическом снижении давления в жидкости из т.3 до т.2 система находится в однофазном жидком состоянии. В т.2 появляются первые пузырьки газа. В этом случае т. 2 называется точкой насыщения, а линия ОА – кривой точек насыщения. Таким образом, одна и та же линия ОА в зависимости от направления изменения параметров состояния может быть кривой точек насыщения или кривой точек конденсации.
Рассмотрим диаграмму Р-V (см. рисунок 2.9.2). При изотермическом (Т1=const) повышении давления из т. 1. в которой система находится в газовой фазе, до т.2 фазовых превращений не происходит. В т.2 появляются первые капли жидкости, т.2 соответствует точке конденсации. Попытка повысить давление приводит к переходу газовой фазы в жидкость, т.е. линия АВ соответствует присутствию газа и жидкости – двухфазному состоянию. В т.3 весь газ переходит в жидкость, точка 3 называется точкой насыщения. Совокупность точек конденсации для различных температур дает кривую точек конденсации, а точки насыщения – кривую точек насыщения. Точка встречи кривой точек насыщения и точек конденсации является критической точкой для данного вещества (например, углеводорода). В данном случае линия Р-V, проходящая через критическую точку, построена для температуры, равной критической. Математически точку встречи кривых насыщения и конденсации можно записать:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.