2) расставляются по “адресам” (a и b) замещающие радикалы;
3) формула дополняется атомами водорода.
Первые члены гомологического ряда этиленовых УВ (С2 ¸С4) в стандартных условиях (1 атм., 250С) являются газами, (С5¸С17) – жидкостями; начиная с С18 – твёрдые (алканы твёрдые с С16).
Олефины практически не растворимы в воде; легче воды
(r< 0,8 г/мл).
p - Электроны находятся на периферии молекулы (см. рис. 10) и в первую очередь подвергаются атаке реагента. Поскольку p-связь менее прочна, чем s-связь, - акены гораздо более реакционноспособные вещества, чем алканы.
Главным химическим свойством алкенов является их способность к реакциям присоединения.
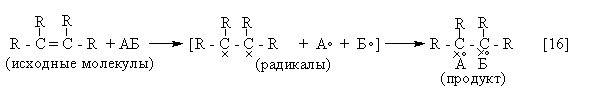 |
В результате разрыва p - связи атомы углерода при двойной связи переходят из второго валентного состояния (sp2) в первое (sp3). У них появляются по одной sp3 - Орбитали с неспаренным электроном каждая (в двухвалентном радикале) – два центра, к которым и присоединяются радикалы А° и Б° (сопоставьте со схемой отщепления в 4.6.3., уравнение 4).
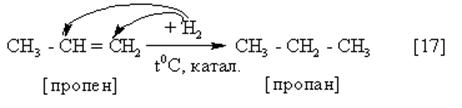 |
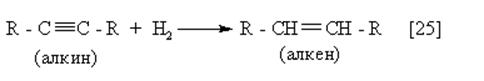
Катализаторами процессов гидрирования могут быть Pt, Pd или Ni.
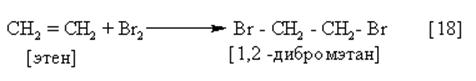 |
Присоединение молекул НХ к несимметричным алкенам происходит в соответствии с правилом В.В. Марковникова (1869 г)
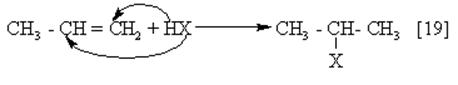 |
(НХ это: HCl, HBr, HOH и мн. др.)
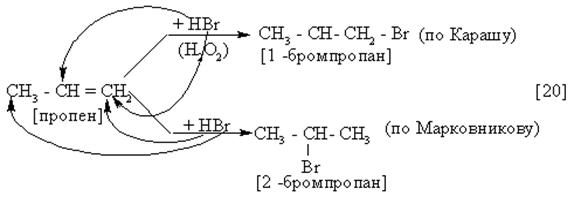 |
Используя или не используя Н2О2, можно “посадить” атом брома в “нужное место” молекулы, т.е. получить галогенид нужной (заданной) структуры, - “руководить” результатом.
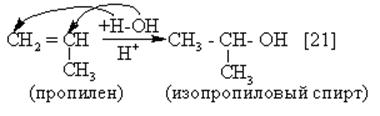 |
Реакции окисления и полимеризации
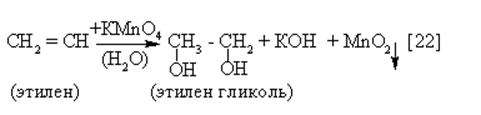 |
Эта реакция обесцвечивание фиолетового раствора KMnO4 – также является качественной (тестом на непредельность, - см. р. 18).
При действии горячим кислым раствором KMnO4 молекулы алкенов “жестко” окисляются с полным разрывом углеродной цепи по двойной связи. Из “осколков” молекулы алкена образуются кислородсодержащие продукты – карбоновые кислоты или кетоны:
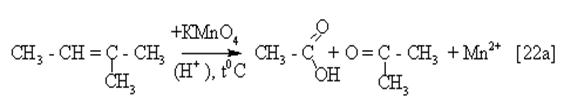 |
(В случае окисления алкена –1 (СН2 = СН – R) одним из продуктов будет СО2, - продукт окисления предварительно образовавшейся метановой кислоты:
HCOOH + [O] ® CO2 + H2O).
В присутствии катализаторов при нагревании и повышенном давлении молекулы алкенов способны соединиться друг с другом, образуя длинные цепные молекулы – полимеры. Происходит реакция за счет разрыва p - связей:
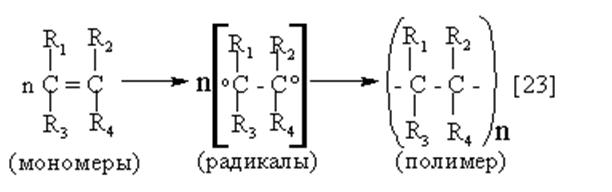 |
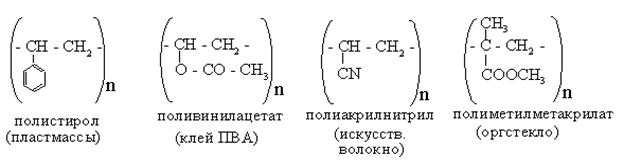 |
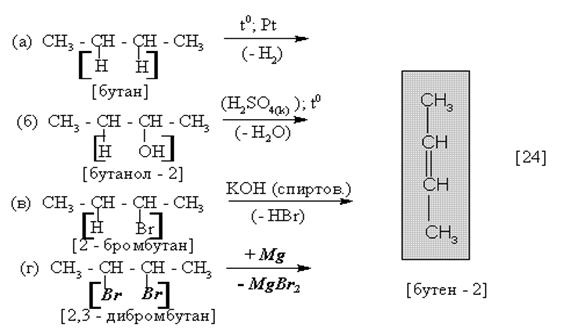 |
Отщепление различных пар атомов (Н – Н; H – OH; H – Br; Br – Br) от разных исходных молекул (соответственно углеводорода (а), спирта (б), моногалогенида (в), вицинального* дигалогенида (г)) требует индивидуальных реагентов и условий проведения реакций ( “к каждому замку свой ключ”).
*Вицинальными называются органические соединения, в которых два заместителя в С – цепи находятся у соседних углеродов.
Реакции дегидрирования (а), дегидратации (б), дегидрогалогенирования (в), протекают в соответствии с правилом отщепления А.М. Зайцева.
 |
и при крекинге алканов ([6])
Диены – углеводороды, имеющие в структуре две двойные углерод – углеродные связи между разными парами атомов углерода. Простейший из них - пропадиен Н2С=С=СН2. Общая формула гомологического ряда алифатических диенов СnH2n-2.. Это еще более ненасыщенные углеводороды, чем алкены.
Источников структурной изомерии три:
(а) изомерия С – скелета;
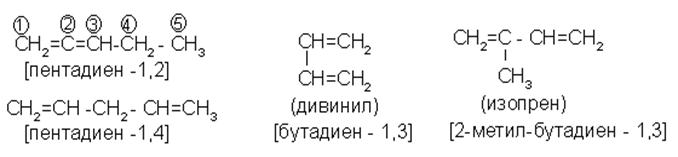 |
(в) цис – транс – изомерия, - различное строение С – скелетов у цисоидных и трансоидных структур диенов (как и у алкенов – см. рис.13).
Наибольший практический интерес представляют сопряженные диены, в которых две двойные связи разделены одной одинарной (см. выше – дивинил, изопрен). Именно из сопряженных диенов получают каучуки, которые в последствии вулканизируют в резину. Кроме того, в природе очень широко распространены изопреноиды – природный каучук, каротины, витамин А, камфара и др.
Первым представителем сопряженных диенов является дивинил [бутадиен – 1,3] H2C=CH-CH=CH2. Углеродные атомы при двойных связях находятся во втором валентном состоянии (sp2). Все десять атомов молекулы С4Н6 располагаются в одной плоскости (рис. 12а). Две двойные связи (С1 =С2) и (С3=С4) при этом взаимодействуют между собой, в результате чего образуется единая для всех четырех атомов углерода p - электронная система (эффект сопряжения двойных связей). Следствием сопряжения является выравнивание длин связей: двойные связи несколько удлиняются, а одинарная (С2 – С3) укорачивается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.