(1) Ациклические (алифатические) – содержат незамкнутые неразветвленные или разветвленные цепи, - как углеродные (карбоцепные), так и с участием других элементов (гетероцепные).
(2) Циклические - содержат замкнутые кольца как из атомов углерода (карбоциклические), так и с участием других элементов (гетероциклические).
3. По характеру связей между элементами:
(1) Насыщенные (предельные) – содержат только простые (одинарные) s-связи (см. 2.2.3).
(2) Ненасыщенные (непредельные) – содержат кратные (двойные или тройные) связи, т.е. содержат наряду с s-связями и p-связи (см. 2.2.4).
Каждая группа в свою очередь, подразделяется на классы органических соединений по видам функциональных групп
Атом – “не атом“ (греч. аtomos - неделимый), т.к. представляет собой “сложное устройство” из ядра и электронов.
Ядро атома в химических превращениях не участвует, а потому для химии строение атома – это ответ на вопрос о количестве и, главное, о характере распределения электронов около ядра. Именно сведения о строении атома являются основой для объяснения химических свойств элемента.
Моделирование – метод (приём) научного познания, при котором изучается не сам объект, а его модель. При этом получают сведения об изучаемом объекте.
Для изучения строения атома используют две модели – планетарную (Э. Резерфорд, Н. Бор, 1911 г) и квантово-механическую (Э. Шредингер, П. Дирак, В. Паули – 1926 г). Оба варианта представлений используют в комплексе с Периодической системой элементов Д.И. Менделеева.
ПМ вместе с периодической системой даёт первичную информацию о строении атома данного элемента: она показывает распределение электронов в оболочке атома по слоям и число электронов в наружном (валентном) электронном слое. Полное число электронов в оболочке атома – порядковый номер элемента в Таблице Менделеева, число валентных электронов – номер группы в Таблице, количество слоёв электронной оболочки – номер периода в котором стоит элемент в таблице.
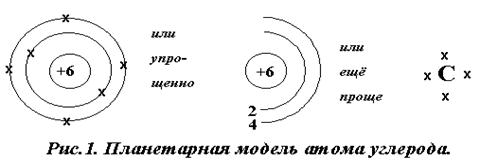 Представлений с позиции ПМ бывает достаточно для
объяснения многих химических явлений, например, окислительно-восстановительных
реакций, процессов электролитической диссоциации, ионно-обменных реакций и др.
Поэтому ПМ до сих пор широко используется в химии, несмотря на её упрощенность.
Представлений с позиции ПМ бывает достаточно для
объяснения многих химических явлений, например, окислительно-восстановительных
реакций, процессов электролитической диссоциации, ионно-обменных реакций и др.
Поэтому ПМ до сих пор широко используется в химии, несмотря на её упрощенность.
Однако есть химические явления, объяснить которые ПМ не может, т.к. сведений о количестве валентных электронов явно не достаточно.
Нет возможности объяснять и структуру молекул, которая и определяет химические свойства органических веществ.
КММ – современная теория строения атома, дающая подробные сведения об электронной структуре атомов. Несмотря на сложность теории, выводы из неё достаточно просты и широко используются даже не знакомыми с “большой” математикой начинающими химиками.
В соответствии с КММ, атом имеет ядро и электронную оболочку, которая состоит из энергетических уровней (похоже на слои из ПМ). Уровни в КММ делятся на подуровни, которые подразделяются на орбитали, где и находятся электроны.
Одной из сложностей восприятия КММ является то, что эта модель – вероятностная картина строения атома, а электрон представляется не частицей (как в ПМ), а электронным облаком – областью пространства, в котором электрон совершает свое движение около ядра.
орбита (понятие из ПМ)- траектория движения электрона около ядра.
Орбиталь – понятие из КММ:
это – геометрическое место точек (область пространства) наиболее
вероятного пребывания электрона около ядра;
это - математическое уравнение, описывающее закон движения
электрона;
это - график данного уравнения – электронное облако
определённой формы.
Формы орбиталей (электронных облаков) вычислили используя возможность построить график по математическому уравнению (y=kx – прямая линия; y=kx2 – парабола; x2 + y2 = R2 – окружность и т.д.).
Для описания структуры электронной оболочки в КММ используют квантовые числа:
Главное n = 1, 2, 3…, 7 (цифровые значения n)
уровень (K), (L), (M), … (буквенные обозначения
цифровых значений n)
Орбитальное l = 0, 1, 2,…,(n-1) (цифровые значения)
подуровень (s), (p), (d),… (буквенные обозначения
цифровых значений l)
Магнитное ml = - l, …, 0, …, +l;
орбиталь
Спиновое ms = +1/2 и -1/2.
электрон
Сами квантовые числа, их цифровые значения и возможное количество значений, которые они принимают, имеют четкий физический смысл.
n характеризует энергию, размер и сложность “ устройства” (количество подуровней) уровня.
Так, n =1 (К – уровень) состоит из одного 1s подуровня (не расщепляется); n =2 (L – уровень) – расщеплен на два подуровня, - 2s и 2p;
n = 3 (M – уровень) – три подуровня, - 3s,3p,3d (см. таблицу 2).
l характеризует энергию и сложность “ устройства” (количество орбиталей) подуровня, а также форму электронных облаков.
Формы орбиталей (электронных облаков) вычислили преобразованиями волнового уравнения Э.Шредингера, - основного “инструмента” квантовой механики.
При подстановке в уравнение Шредингера l=0 (s) получается уравнение шаровой поверхности x2 + y2 + z2 = R2, из чего сделан вывод: s – Орбиталь имеет форму шара.
Подстановка в уравнение Шредингера l= 1 (p) дает математическое уравнение, описывающее поверхность симметричной восьмерки, вращаемой вокруг её продольной оси.
Вывод: p – Орбиталь имеет форму “объёмной восьмёрки“ или “гантели” (см. рис.3).
ml характеризует ориентацию орбиталей в пространстве относительно магнитной оси Земли. Количество цифровых значений
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.