Состоянию для любого атома с Еmin соответствует “завершенная снаружи“ электронная оболочка (для атомов 1го периода –Н и Не – это два электрона, для всех остальных элементов восемь электронов, - правило октета). Способов достиженияЕmin у атомов несколько.
Используются два способа достижения атомами состояния с Еmin:
(а) приём электронов, недостающих до завершения наружного слоя электронной оболочки;
(б) отдача наружных электронов для “обнажения “ ранее завершенного предвнешнего слоя электронной оболочки.
Оба способа достижения атомами Еmin реализуются одновременно при возникновении ионной связи:
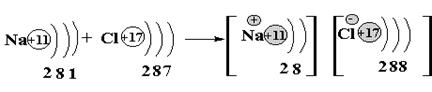 В результате передачи электрона от атома Na
атому Cl оба атома приобрели Еmin
В результате передачи электрона от атома Na
атому Cl оба атома приобрели Еmin
(8 электронов “снаружи” у каждого). Теперь атомы стали противоположно заряженными ионами, которые притягиваются друг к другу электростатически, - ионная связь.
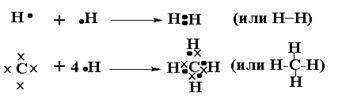 Третий способ
достижения атомами Еmin -
обобществление электронов соединяющихся атомов с одновременной достройкой
электронных оболочек соединяющихся атомов.
Третий способ
достижения атомами Еmin -
обобществление электронов соединяющихся атомов с одновременной достройкой
электронных оболочек соединяющихся атомов.
Между соединяющимися атомами возникают общие электронные пары, находящиеся в совместном пользовании обоих атомов. В итоге сразу несколько атомов достигли Еmin (здесь 2 электрона у атома Н и 8 электронов у атома С).
Общие (связывающие) электронные пары – ковалентная связь, - главный вид связи в органической химии.
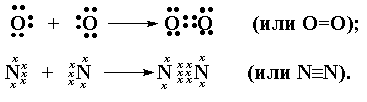 Связи между
органогенными элементами могут быть как простые (одинарные), так и кратные
(двойные или тройные, осуществляемые, соответственно, двумя или тремя общими
электронными парами).
Связи между
органогенными элементами могут быть как простые (одинарные), так и кратные
(двойные или тройные, осуществляемые, соответственно, двумя или тремя общими
электронными парами).
Такое, хотя и очень упрощенное, представление о ковалентной связи с позиций ПМ удобно использовать для обсуждения (объяснения) способов разрыва и образования связей, механизмов и типов органических реакций.
Для объяснения структуры молекул а, следовательно, и их химических свойств ПМ недостаточна. Структура молекул может быть объяснена только с позиций квантово-механической модели строения атома.
С позиций КММ химическая связь – это перекрывание орбиталей соединяющихся атомов с образованием между их ядрами областей повышенной электронной плотности.
Способов перекрывания орбиталей - два:
1) “лобовое “ перекрывание (s - связь);
2) “боковое “ перекрывание (p - связь).
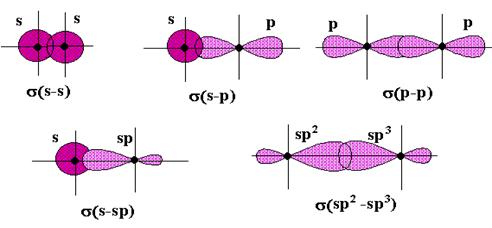 |
Схемы образования s - связи перекрыванием орбиталей различного типа
В образовании p - связи могут участвовать только симметричные негибридные р - орбитали* соединяющихся атомов, ориентированные вдоль параллельных осей пространства.
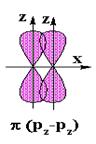 При этом способе перекрывания орбиталей область повышенной
электронной плотности (область перекрывания) не лежит на линии связи.
При этом способе перекрывания орбиталей область повышенной
электронной плотности (область перекрывания) не лежит на линии связи.
Важно при этом подчеркнуть, что p - связь – это не двойная связь, это такой способ перекрывания орбиталей. p - связь - одинарная, образованная одной общей электронной парой (как и s) ковалентная связь. Но p - электроны находятся на периферии молекулы и в первую очередь подвергаются “атаке“ реагента. Кроме того p - связь менее прочна, чем s - связь, а потому соединения с p - связью обладают повышенной реакционной способностью.
* В образовании p - связей могут также участвовать и d – орбитали (здесь не рассматриваются).
С позиций КММ кратная связь - это одновременное наличие s - и p - связей между двумя атомами .
Если между атомами есть химическая связь, - s -связь есть всегда. Двойная связь - это одна s - и одна p - связи (см. рис.11). Тройная связь - это одна s - и две p - связи (см. рис.12). При изображении структурных формул s - и p - связи показывают одинаковыми валентными штрихами. Важно при этом помнить о различной природе s - и p - связей.
а) порядок связи атомов в молекуле (“кто с кем“ связан);
б) характер взаимного расположения атомов в пространстве друг относительно друга;
в) типы связей между атомами.
Структурообразующей является s - связь, поскольку она направленная.
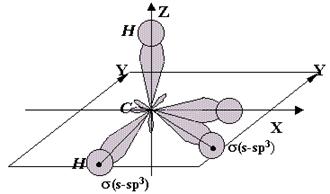 Направленность
s - связи выражается в том,
что несколько атомов, связанных с одним и тем же (центральным) атомом молекулы,
располагаются в пространстве строго по направлениям ориентации гибридных орбиталей
центрального атома.
Направленность
s - связи выражается в том,
что несколько атомов, связанных с одним и тем же (центральным) атомом молекулы,
располагаются в пространстве строго по направлениям ориентации гибридных орбиталей
центрального атома.
 |
(a) (б)
H
H
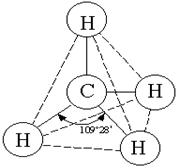
Структура (а) и модель (б) молекулы метана СН4 .
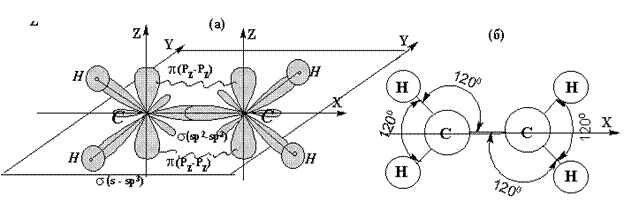 |
Структура (а) и модель (б) молекулы этилена С2Н4.
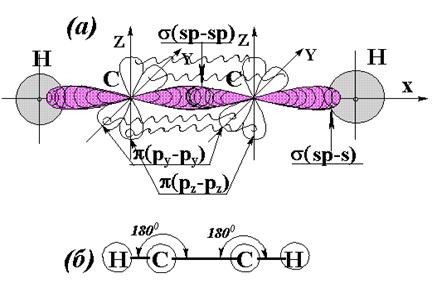 |
Структура (а) и модель (б) молекулы ацетилена С2Н2.
Углерод в третьем валентном состоянии (sp).Атомы Н располагаются по направлениям ориентации гибридных sp – орбиталей углерода; все четыре атома молекулы лежат на одной линии, - молекула ацетилена линейна. Между атомами углерода три связи: 1) s (sp – sp) , 2) p (рz - рz) и 3) p (рy - рy). Между атомами углерода и водорода 2 s (sp – s) связи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.