Химия – наука о веществах и способах их превращения.
Все вещества до начала 19го века делили по их происхождению на три группы: (а) минеральные,
(б) растительные и
(в) животные.
В 1807г Й. Берцеллиус предложил две группы веществ:
А) Н е о р г а н и ч е с к и е (например: воздух, вода, песок, железо, золото, соль и др.).
Б) О р г а н и ч е с к и е - от лат. Organismus – живое тело, живое существо (например: жиры, крахмал, древесина, сахар и др.)
Органические вещества резко отличаются по свойствам от неорганических, например:
![]()
![]()
![]() А) Лед 0 0С Вода (ж) 100 0С
Пар 1000 0С Раскаленный пар
А) Лед 0 0С Вода (ж) 100 0С
Пар 1000 0С Раскаленный пар
При понижении температуры вновь получается неорганическое вещество в исходном состоянии.
![]()
![]()
![]() Б) Масло (тв.) Масло
(ж) Дым, гарь, -
Б) Масло (тв.) Масло
(ж) Дым, гарь, -
т.е., после сравнительно небольшого температурного воздействия органическое вещество перестает быть таковым, - превращается в неорганическое.
“Обратной дороги” долго не знали. Первое открытие на этом пути совершил в 1828 г Ф. Вёлер:
![]() NH4OCN(p-p) T.кип.
СО(NH2)2
NH4OCN(p-p) T.кип.
СО(NH2)2
(соль; цианат аммония) (мочевина)
были синтезированы и другие органические вещества:
- уксусная кислота – 1845 г, А. Кольбе;
- жир – 1854 г, М. Бертло;
- сахаристое вещество – 1861 г, А.М. Бутлеров.
Стало ясно, что законы химии едины для всех веществ.
В природе более 100 химических элементов,
150000 неорганических соединений и более 10 000 000 органических.
Основу органических соединений составляют всего шесть органогенных (“рождающих органику”) элементов: C,H,O,N,P,S.
(1) между собой они образуют прочные ковалентные связи и прочные каркасы молекул;
(2) только эти элементы (кроме Н) способны образовывать кратные (двойные и тройные) связи;
(3) у г л е р о д – главный органогенный элемент – обладает уникальным свойством: его атомы могут соединяться друг с другом в неограниченных количествах, образуя кольца и цепи, составляющие углеродный скелет самых разнообразных органических соединений.
Органическая химия – химия углеводородов и их производных.
биогенными (от греческого bios – жизнь, genes – род, - “рождающие жизнь“). Это металлы ( например, Fe в составе гемоглобина крови) и неметаллы (например, Se в сетчатке глаза).
1. В органических молекулах атомы соединяются в строго определенной последовательности в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен.
2. Порядок связи атомов, характер их взаимного расположения в пространстве и вид химических связей между ними называется химическим строением или структурой молекулы.
Понятие структура молекулы включает три аспекта:
(а) химическое строение – вид и порядок чередования атомов;
(б) электронное строение - вид химических связей между атомами
((С – С), (С = С) или (С º С));
(в) пространственное строение – характер взаимного расположения атомов друг относительно друга в пространстве.
3. Свойства органических соединений определяются не столько составом молекул, сколько их структурой.
4. Различные атомы или группы атомов в молекуле оказывают взаимное влияние друг на друга.
5. Химическая структура молекулы может быть представлена единственной формулой, которая отражает все химические свойства данного вещества.
1. Молекулярные формулы (С3Н8; С2Н6О; С7Н5N3О6; С47Н94О5N2Р и т.д.) содержат очень мало информации для объяснения химических свойств органических соединений. Это первичная информация, которая используется, например, в количественных расчётах (см. гл.3).
2.Структурные формулы содержат основную информацию о химических свойствах органических веществ. Здесь элементы обозначаются их химическими символами, а связь между ними валентным штрихом
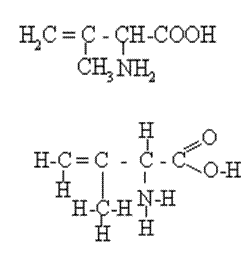 Кратные
связи (двойные и тройные) показываются соответствующим количеством валентных
штрихов. Способов записи структурных формул несколько:
Кратные
связи (двойные и тройные) показываются соответствующим количеством валентных
штрихов. Способов записи структурных формул несколько:
а) Полная (развёрнутая) формула - показ всех элементов и связей между ними в молекуле, - используется редко.
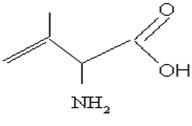
б) Компактная запись. Здесь не показываются связи водорода с другими элементами, обозначается только количество атомов Н, связанных с каждым элементом, - используется наиболее часто.
в) Условная запись. Здесь атомы С и Н вообще не показывают. Структура изображается геометрической фигурой, где обозначаются типы связей между углеродами и фрагменты структуры с другими атомами.
 В изломах и окончаниях линий – имеются в виду атомы углерода с
соответствующим количеством атомов водорода. Условная запись используется обычно
для изображения циклических структур (см. циклоалканы и арены) или структур
многоуглеродных молекул (см. углеводы).
В изломах и окончаниях линий – имеются в виду атомы углерода с
соответствующим количеством атомов водорода. Условная запись используется обычно
для изображения циклических структур (см. циклоалканы и арены) или структур
многоуглеродных молекул (см. углеводы).
Изомерия – природное явление существования нескольких соединений одинакового состава с различными свойствами.
Изомеры – соединения одинакового состава, но различной структуры и, как следствие, с различными свойствами. (см. п.1.3.3. и табл.1).
Изомерия – основной источник (причина) многообразия органических соединений.
Различия в свойствах изомеров.
|
Свойства |
С2Н6О |
|
|
СН3-СН2-ОН Этиловый спирт |
СН3-О-СН3 Диметиловый эфир |
|
|
Агрегатное состояние |
Жидкость |
Газ |
|
T. кип., 0C |
+78,30 С |
-23,60 С |
|
|
СН2-СН3 Н2О + С2Н4 ОН |
не реагирует |
|
(без нагрева) |
2С2Н5ОН + 2Na 2С2Н5ОNa + Н2 |
не реагирует |
|
|
C2H5OH + HJ C2H5J + H2O |
CH3-O-CH3 + HJ CH3OH + CH3J |
Классификация –прием (метод) научного познания, в котором большое количество изучаемых объектов делится на группы по общим признакам для каждой группы объектов.
В зависимости от вида группового признака органические соединения делятся на такие группы.
1. По составу:
(1) Углеводороды, - содержат только атомы С и Н.
(2) Гетеросоединения, - содержат кроме атомов С и Н другие элементы: O,N, галогены и др.
2. По типам углеродных скелетов:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.