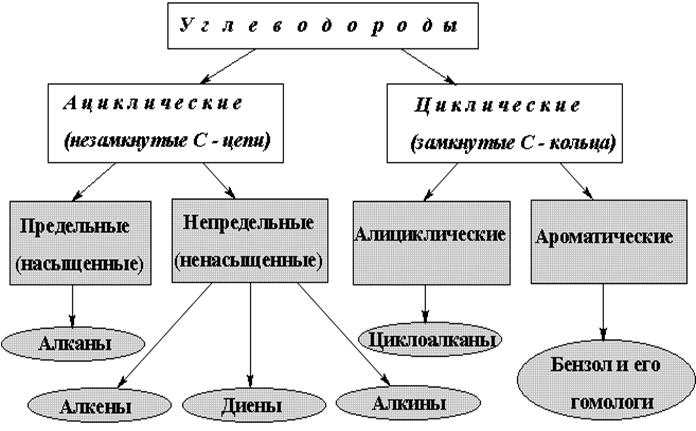
Углеводороды – соединения из двух видов элементов: углерода и водорода. Они различаются по строению углеродного скелета и по характеру связей между атомами углерода.
|
 |
 |
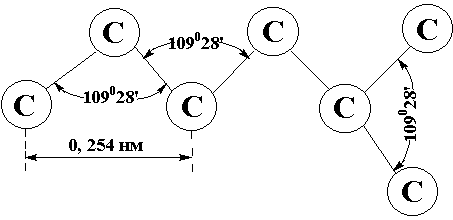
Атомы углерода находятся в первом валентном состоянии (sp3 – гибридизация). С – скелеты алканов имеют зигзагообразную форму, т.е. “изломаны” в пространстве под валентными тетраэдрическими углами 109028’.
 |
Атомы (С – С) и (С – Н) соединены одинарными связями.
Простейшим представителем алканов является метан СН4 ( структуру молекулы метана см. рис. 10). Он является “родоначальником” гомологического ряда метана (ГРМ) - серии сходных по свойствам однотипных соединений имеющих общую формулу СnH2n+2.
Гомологи (члены данного класса органических соединений) отличаются друг от друга по составу на одну или несколько групп атомов СН2, называемой гомологической разностью.
Учение о гомологии значительно упростило изучение органической химии. Гомологи – соединения с однотипной структурой, близкими и закономерно изменяющимися химическими и физическими свойствами. Изучение свойств небольшого числа гомологов позволяет делать вывод о свойствах большого числа других членов гомологического ряда.
Для наименования алканов используются греческие числительные
|
1 – моно |
5 - пента |
9 – нона |
|
2 – ди |
6 – гекса |
10 – дека |
|
3 – три |
7 – гепта |
11 – ундека |
|
4 - тетра |
8 - окта |
12 - додека |
Названия алканов образуются от корня названия цифры с добавлением суффикса “ан”: 5 – пента, С5Н12 – пентан; 8 – окта, С8Н18 - октан и т.д.
Исключение – тривиальные названия первых четырех гомологов:
1 - метан, 2 - этан, 3 - пропан, 4 - бутан.
Названия алканов по греческим числительным начинаются с пентана.
В зависимости от положения в цепи атом углерода может быть
первичный (I) -(связан с одним С, “концевой”),
 |
третичный (III) (связан с тремя С) и
четвертичный (IV) (связан с четырьмя С):
Гомологический ряд алканов (СnH2n+2) с нормальной (неразветвленной) С – цепью
|
n |
Название |
Формула |
Т.пл., 0С |
Т.кип., 0С |
Плотн. r, г/см3 |
Возможн. Число изомеров |
|
1 2 3 4 |
Метан Этан Пропан Бутан |
СН4 СН3 – СН3 СН3 – СН2 – СН3 СН3 – (СН2)2 – СН3 |
-183 -172 -188 -155 |
-161 -89 -42 -0,5 |
0,424 0,546 0,584 0,600 |
1 1 1 2 |
|
5 6 7 |
Пентан Гексан Гептан |
СН3 – (СН2)3 – СН3 СН3 – (СН2)4 – СН3 СН3 – (СН2)5 – СН3 |
-130 -95 -91 |
36,1 68,7 98,4 |
0,625 0,659 0,684 |
3 5 9 |
|
8 9 10 |
Октан Нонан Декан |
СН3 – (СН2)6 – СН3 СН3 – (СН2)7 – СН3 СН3 – (СН2)8 – СН3 |
-57 -54 -30 |
126 151 174 |
0,703 0,718 0,730 |
18 35 75 |
|
15 |
Пентадекан |
СН3 – (СН2)13 – СН3 |
+10 |
+270 |
0,749 |
4347 |
|
20 |
Эйкозан |
СН3 – (СН2)18 – СН3 |
+37 |
+343 |
0,786 |
366319 |
Атомы водорода, связанные с этими углеродами, тоже называются первичные, вторичные и третичные (четвертичных – нет).
Углеводороды нормального (неразветвленного) строения содержат только первичные и вторичные углероды. Разветвленные – как минимум один третичный или четвертичный углерод. Возможность изомерии алканов появляется начиная с бутана (n=4).
С увеличением n количество возможных изомеров очень быстро возрастает.
Изомеры углеводородов отличаются друг от друга количеством и местом положения третичных и четвертичных углеродов в С – цепи.
Для наименования алканов с разветвленной структурой используют названия замещающих групп – радикалов, - частей молекул углеводородов, условно (мысленно) выделенных отнятием одного* атома водорода. Название радикала образуется от названия алкана путем замены суффикса ”ан” на суффикс “ил”. Общее название одновалентных радикалов - алкилы; условное их обозначение – R.
Кроме количества атомов углерода, алкилы (начиная с пропилов) могут “различаться положением свободной валентности” у первичного, вторичного или третичного атомов углерода.
|
n |
Молекулы (алканы) |
Радикалы (алкилы) |
|
1 |
СН4 метан |
СН3 – метил |
|
2 |
СН3 – СН3 этан |
СН3 – СН2 – этил |
|
|
СН3 – СН2 –СН3 пропан |
СН3 – СН2 –СН2 – пропил |
|
СН3 – СН – СН3 изопропил |
||
|
|
СН3 – СН2 – СН2 – СН3 Бутан |
СН3 – СН2 – СН2 – СН2 – Бутил |
|
СН3 – СН2 – СН – СН3 вторбутил (вторичный бутил) |
||
|
СН3 – СН2 – СН3 СН3 изобутан |
СН3 – СН – СН2 – СН3 изобутил |
|
|
СН3 СН3 – С – СН3 третбутил (третичный бутил) |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.