ml при данном l– количество вариантов ориентации орбиталей в пространстве, т.е. количество орбиталей из которых состоит подуровень данного типа (см. таблица 2).
Так, при l=0 (s) ml = 0 (единственно возможное цифровое значение). Смысл этого в том, что s – Орбиталь может быть ориентирована в пространстве единственным способом, так как имеет форму шара (рис.3а).
При l= 1(p) ml может принимать три цифровых значения:
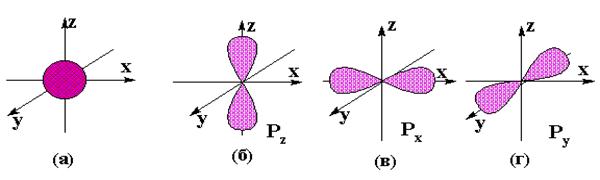 |
Формы и виды орбиталей.
Более сложные формы d- и f- орбиталей здесь не рассматриваются
ms – спиновое квантовое число (от английского speen - веретено) принимает два цифровых значения: +1/2 и - 1/2; оно характеризует два возможных направления вращения электрона вокруг собственной оси (по или против часовой стрелки).
Возможные цифровые значения l и ml при заданных n.
|
n |
Количество значе- Ний l при данном n |
l |
ml |
Количество значений ml при данном l |
|
(подуровней в уровне) |
(орбиталей в подуровне) |
|||
|
1(K) |
Один |
0(s) |
0 |
Одна |
|
2(L) |
два |
0(s) |
0 |
Одна |
|
1(p) |
-1, 0, +1 |
Три |
||
|
3(M) |
Три |
0(s) |
0 |
Одна |
|
1(p) |
-1, 0, +1 |
Три |
||
|
2(d) |
-2, -1, 0, +1, +2 |
Пять |
Описание электронной структуры по КММ – электронная формула
nlx, показывающая распределение электронов по уровням и подуровням электронной оболочки атома. Здесь n обозначается цифрой (номер уровня); l– буквой (вид подуровня); x – количество электронов на подуровне (в виде степенного индекса при l).
Распределение шести электронов в оболочке атома углерода показывается так: 1s2 2s2 2p2.
Еще более подробные сведения об электронной структуре – распределение электронов по орбиталям - можно получить графическим методом Ф. Хунда (1931г). Здесь орбиталь не зависимо от формы, изображается клеточкой-ячейкой, подуровень – соответствующим количеством ячеек (s , p , d ), а электроны - стрелками в этих ячейках (направление стрелок вверх или вниз условно обозначает два направления спинов электронов).
![]() Обычно
методом Хунда показывают распределение по орбиталям только валентных электронов,
которые и участвуют в образовании химических связей.
Обычно
методом Хунда показывают распределение по орбиталям только валентных электронов,
которые и участвуют в образовании химических связей.
Для углерода это 2s2 2p2 , а изображение s- и p – подуровней одного уровня на разной высоте – это способ показать, что энергия 2p – подуровня выше, чем 2s – подуровня.
По правилу Хунда: электроны одного подуровня (при возможности ) остаются неспаренными (параллельные спины). Это возможно, когда число электронов не превышает число ячеек (орбиталей ) на подуровне. У двух электронов на одной орбитали (в одной ячейке) антипараллельные спины (спаренные электроны).
Метод Хунда (совместно с постулатом о возбуждении атомов) дает возможность объяснить, например, переменность валентности элементов. Валентность определяется числом неспаренных электронов на валентном уровне оболочки атома. Постулат о возбуждении: атомы вступают в химическое взаимодействие, как правило, в возбужденном состоянии. Возбуждение атома – переход электронов с подуровня на подуровень в пределах энергетического уровня.
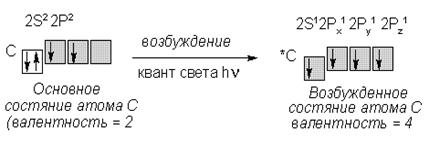 Затрата энергии на возбужде-ние
атома “окупается “ впоследствии “выигрышем “ энергии, выделяющейся при
Затрата энергии на возбужде-ние
атома “окупается “ впоследствии “выигрышем “ энергии, выделяющейся при
образовании четырех химии-ческих связей вместо двух.
Схема возбуждения атома углерода
и изменения его валентности.
Энергетические состояния s- и p- электронов различны, поэтому можно ожидать образования с их участием связей разной прочности и несимметричных молекул.
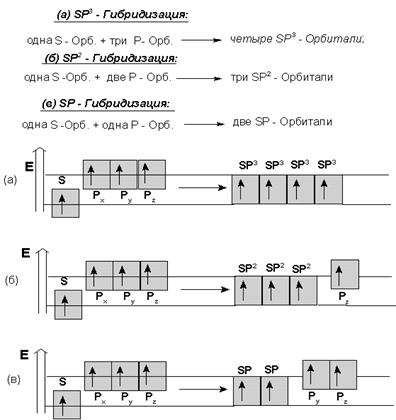 Гибридизация – образование из нескольких
разных простых АО такого же количества одинаковых, но сложных (гибридных) АО,
усредненных по энергиям (рис.5) и по форме (рис.6). Тип гибридизации и вид
образующихся при этом гибридных орбиталей определяется видом и количеством
простых АО, участвующих в “смешении“ (лат. hibrida –
потомство, полученное скрещиванием разных видов или сортов, - здесь – разного
вида простых АО):
Гибридизация – образование из нескольких
разных простых АО такого же количества одинаковых, но сложных (гибридных) АО,
усредненных по энергиям (рис.5) и по форме (рис.6). Тип гибридизации и вид
образующихся при этом гибридных орбиталей определяется видом и количеством
простых АО, участвующих в “смешении“ (лат. hibrida –
потомство, полученное скрещиванием разных видов или сортов, - здесь – разного
вида простых АО):
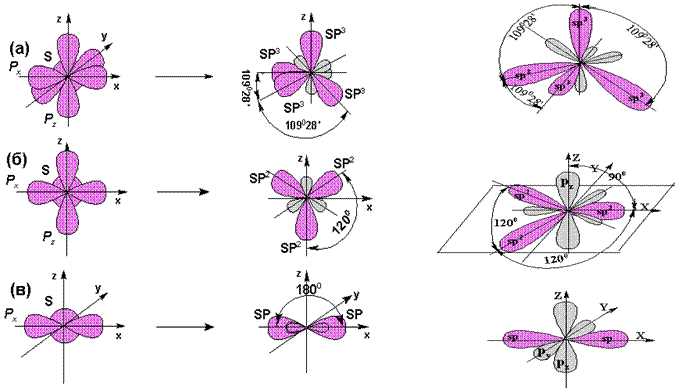 |
Три типа гибридизации атомных орбиталей и ориентации гибридных орбиталей в пространстве:
(а) sp3 – объёмная;
(б) sp2 – плоская;
(в) sp – линейная.
Три валентных
состояния атома углерода:
(а) Первое (sp3);
(б) Второе (sp2);
(в) Третье (sp).
Негибридные рz и py - Орбитали (на рис.7б и 7в) впоследствии участвуют в образовании p - связей (рис.9, 11, 12).
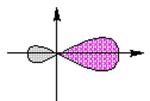 Форма гибридных орбиталей всех типов (sp, sp2 и sp3)
одинакова: сильно вытянутая в одну сторону от ядра атома несимметричная
объемная восьмёрка.
Форма гибридных орбиталей всех типов (sp, sp2 и sp3)
одинакова: сильно вытянутая в одну сторону от ядра атома несимметричная
объемная восьмёрка.
Гибридные орбитали конкретного атома – одинаковые по форме и по энергии - ориентируются в пространстве симметрично друг относительно друга.
После гибридизации любого типа общее число атомных орбиталей (гибридных и негибридных) сохраняется.
Химическая связь – взаимодействие между атомами, в результате которого образуется устойчивая многоатомная система – молекула.
Причина образования связи между атомами – стремление атома, как и любой сложной системы, к устойчивому состоянию, т.е. к состоянию с минимальной энергией (Еmin).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.