Накопление или уменьшение количества СО2 существенно влияют на кислотно-основное состояние. СО2 физически растворяется в плазме крови. После растворения СО2 вступает в химическую реакцию, в которой вода и двуокись углерода взаимодействуют и образуют угольную кислоту
СО2 + Н2О <->H2CO3 (уравнение 3)
Хотя сама СО2 не кислота, но она является предшественником угольной кислоты (уравнение 3), которая диссоциирует на ион водорода (Н+) и ион бикарбоната (НСО3-- ).
Н2СО3 <-> Н+ + НСО3-- (уравнение 4)
Н2СО3 является слабой кислотой, а НСО3-- достаточно активным анионом. Таким образом, в результате физического растворения СО2 в плазме меняется рНа. Так как растворение СО2 сразу же сопровождается образованием угольной кислоты, то накопление СО2 приводит к ацидозу. Поэтому при гиповентиляции развивается дыхательный ацидоз. При гипервентиляции СО2 избыточно удаляется из организма и пополняется из нестойкой Н2СО3. В свою очередь происходит смещение уравнения 4 влево в сторону образования угольной кислоты. В результате снижается концентрация Н+, увеличивается рН, развивается дыхательный алкалоз.
Схематически физиологическое системы двуокись углерода/бикарбонат можно изобразить в виде физического аналога сообщающихся сосудов с перетекающими жидкостями ( рисунок 3 ).
![]()
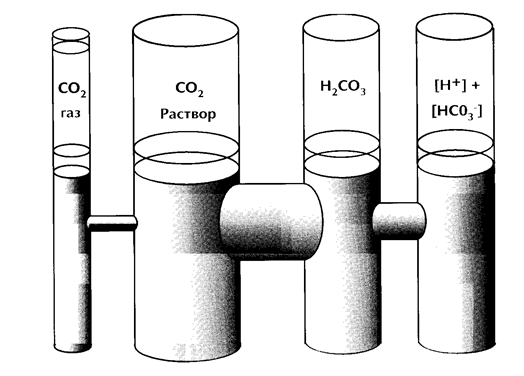
Рис. 3. Физический аналог равновесия системы СО2 / НСО3--.
Уровень жидкости во всех отделах при равновесном состоянии постоянен. При изменении уровня жидкости в одном из отделов в других уровень будет стремиться к новому равновесию со скоростью, пропорциональной диаметру переходных трубок.
При устойчивом состоянии уровень жидкости одинаков в отделах СО2 - газ, СО2 - жидкость, Н2СО3 и ([Н+] х [НСО3--]). Повышение (снижение) уровня жидкости в любом из сосудов приведет с большей или меньшей скоростью к выравниванию уровня в других,
Определение раСО2 клинически используется как индекс, отражающий дыхательный компонент кислотно-основного состояния.
НСОз--.
Концентрация бикарбоната [НСО3--] выражается в ммоль/л. Как следует из рисунка 3, произведение [Н+] х [НСО3--] постоянно по отношению к уровню СО2 в альвеолярном воздухе, СО2 растворенном в плазме и концентрации Н2СО3 в крови. Уравнение 2 для диссоциации угольной кислоты будет иметь вид:
РН=НСО3 / Н2СО3
Следовательно, при повышении концентрации НСО3-- концентрация Н+ должна уменьшаться, а рН будет увеличиваться, что приводит к сдвигу в сторону алкалоза. Снижение НСО3-- будет приводить к уменьшению рНа и к ацидозу. Концентрацию бикарбоната можно использовать в качестве показателя «метаболического компонента» КОС.
Нормальная концентрация НСО3-- составляет 22 - 26 ммоль/л.
Хотя кроме бикарбонатного буфера в крови присутствуют другие основания и кислоты, тем не менее соотношение НСО3_ / Н2СО3 характеризуется высокой чувствительностью и динамичностью и способно отражать суммарные изменения системы кислоты/основания.
При оценке бикарбоната с помощью анализаторов регистрируют 2 показателя - истинный (актуальный) бикарбонат и стандартный бикарбонат.
Истинный бикарбонат (HCO3--act).
Уравнение Гендерсона-Гассельбаха (уравнение 1 ) для концентрации иона бикарбоната решается следующим образом:
lg[HCO3-] = рН + lg (рСО2 х 0,0307) - 6,105 (уравнение 7)
Расчет на основе этого выражения был рекомендован Международной Федерацией Клинической Химии (IFCC) для использования в клинико-диагностических исследованиях. Рассчитанная по уравнению 7 концентрация бикарбоната эквивалентна его активности в воде плазмы, так как рН и рСО2 измеряются для воды плазмы. Для истинной плазмы могут быть определенные отклонения [НСО3_ ], если в ней увеличено содержание липидов и белков. Правильнее использовать рассчитанные значения, чем непосредственно измеренные, так как нужно использовать комплекс показателей характеристики КОС, а они определяются приборами для воды плазмы.
Стандартный бикарбонат (HCO3_std).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.