2.3.2.3. Хронический хеликобактерный гастрит
Первый номер журнала Digestion за 1998 год открывает передовая статья под названием "Век Helicobacter pylori. Парадигмы утрачены, парадигмы вновь обретены". Такое название статьи не случайно. Открытие, а затем изучение H.pylori совершили революцию в понимании. Здесь мы имеем в виду не только тот факт, что такое, казалось бы "неинфекционное" заболевание, как язвенная болезнь, оказалось патогенетически зависимым от инфекции. Речь идет о том, что научное признание того, что H.pylori является возбудителем хронического гастрита, а через него язвенной болезни и рака желудка, открыло перед исследователями совершенно новую картину возникновения патологических Процессов, новые, до этого нераскрытые механизмы взаимодействия микро- и макроорганизма.
нимать другая, более интересная идея — в каком случае для человека H.pylori коменсал, сапрофит или паразит. Причиной этому явилось не только открытие штаммов H.pylori, имеющих разную вирулентность и патогенность, но также и то обстоятельство, что в различных ситуациях (например на фоне лечения) один и тот же штамм может проявлять разную патогенность и вирулентность. M.Blaser (1997) вообще считает, что к H.pylori, как к "медленной инфекции", термины уровня сапрофит, паразит, коменсал неприменимы, поскольку микроб реализует свою "патогенность" с помощью регуляции экспрессии различных генов в той степени, в какой это диктуется реакцией макроорганизма (92). Микроб и макроорганизм формируют тонко настроенную систему равновесия (схема 2), в результате изменения которого и формируется конкретное заболевание с определенными клиническими показателями и прогнозом.
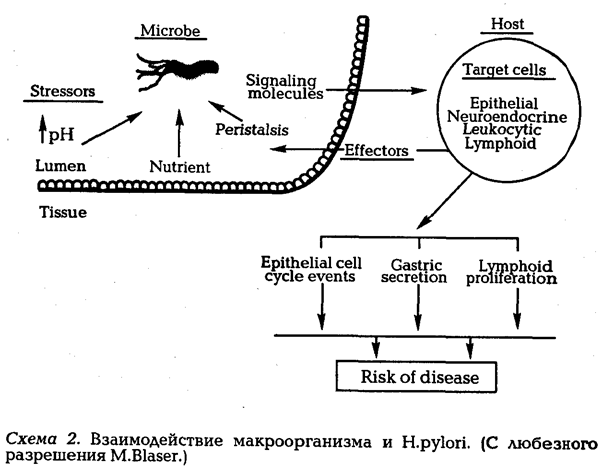
Как видно из рисунка, основными мишенями для H.pylori в слизистой сСюлочке желудка являются: эпителиоциты, нейроэндокринные клетки, лейкоциты и лимфоциты. Взаимодействие с каждым видом клеток или одновременно с несколькими приводит к ряду событий, из которых наиболее важными являются: качественные и количественные изменения инфильтрации слизистой оболочки желудка клетками лимфо-идного ряда, изменение желудочной секреции, нарушение клеточного цикла эпителиоцитов. Как видно из этого короткого списка, H.pylori, взаимодействуя с макроорганизмом, изменяет как раз те показатели, ко-
торые тесно связаны с сущностью хронического гастрита: воспалением и клеточным обновлением.
В разделе общей патоморфологии мы подробно описывали такой показатель хронического гастрита как активность, который является обязательным для хеликобактерного гастрита, он — всегда активный. Тем не менее существуют особенности, которые следует обсудить особо.
Помимо чисто морфологических наблюдений картин активности, которые показали, что степень активности гастрита впрямую зависит от степени обсемененности и "адгезии" H.pylori слизистой оболочки желудка (93,94), имеются и экспериментальные объяснения этого феномена, Установлено, что инфильтрация полиморфно-ядерными лейкоцитами стимулируется как непосредственно H.pylori, которые выделяют водорастворимый белок активирующий нейтрофилы (95), так и опосредовано, путем стимуляции секреции интерлейкина-8 эпителиоцитами желудка, а затем и запуском всего воспалительного каскада с секрецией различных цитокинов. И, хотя, точка приложения у них одна — активация лейкоцитарного звена иммунитета, значение их различно.
Белок активирующий нейтрофилы был изучен достаточно хорошо, и были показаны конкретные механизмы, с помощью которых он активирует нейтрофилы. Прежде всего, обработка нейтрофилов водорастворимыми экстрактами H.pylori приводила к экспрессии нейтрофилами CDllb/CDIS, которые стимулировали ICAM-1 зависимую адгезиюЛейкоцитов к эндотелиальным клетками как in vitro, так и in vivo (96). Исследования на крысах показали, что такая стимулированная адгезия нейтрофилов изменяет микроциркуляцию, приводит к дегрануляции тучных клеток, к агрегации лейкоцитов с пластинками (97) и к транссудации (96). Иммуногенность этого белка до настоящего времени не ясна. Ген, кодирующий его синтез (парА), обнаружен у всех известных сегодня штаммах H.pylori (12). Видимо, следует признать, что этот белок является универсальным для микроба, и, очевидно, что именно это объясняет тот факт, что инфильтрация полиморфно-ядерными лейкоцитами наблюдается при хеликобактерном гастрите всегда. Другое дело, что выраженность ее может быть разной, но это, как мы упоминали выше, зависит от степени обсемененности и "адгезии" H.pylori.
В свою очередь, адгезивные свойства H.pylori определяют секрецию интерлейкина-8 эпителиоцитами, причем наиболее сильно этот феномен выражен у штаммов I типа (СадА , VacA'1'). Интересно, что СадА'1' штаммам H.pylori характерна степень обсемененности слизистой оболо-; чки желудка в 5 раз большая, чем штаммам без СадА (98), и этим также f регулируется выраженность активности гастрита. Более того, инфици-рование таким штаммом увеличивает экспрессию адгезионных рецепторов ELAM-1, клетками эндотелия (46% против 16% у СадА отрицательных штаммов) (99). В последнее время появились данные о том, что не столько СадА, сколько неизвестный белок вызывает все вышеупомянутые эффекты, причем ген, кодирующий его сцеплен с СадА геном (100). Таким образом, СадА белок может быть не столько причиной описанных феноменов, сколько их маркером, однако, это еще предстоит выяснить.
То, что активность — типичный признак гастрита, вызванного H.pylori, показывают исследования других хеликобактерных гастритов. Так, изучение 28 больных, инфицированных Helicobacter heilmannii (ко-йнфекция с H.pylori была исключена), показало, что активным гастрит
был только у 13 больных (101). В то же время гастрит, вызванный H.cinae-di, ничем не отличался от классического, вызванного Н.pylori. (Л.В.Кудрявцева, личное сообщение).
Таким образом, подводя краткий итог обсуждению влияния H.pylori на лейкоциты в слизистой оболочке желудка, можно заключить, что активность хеликобактерного гастрита вероятнее всего видоспецифична и обусловлена секрецией водорастворимого белка. Адгезивные способности штамма H.pylori для нее не имеют большого значения, в то же время степень активности впрямую зависит от адгезии (вирулентных свойств штамма), определяемой экспрессией СадА или сцепленных с ним генов.
Влияние H.pylori на лимфоциты можно считать определяющим в хронизации гастрита. Еще на заре хеликобактериологии высказывалась гипотеза, что H.pylori может длительное время персистировать в слизистой оболочке желудка не только благодаря своим уникальным свойствам (способности к адгезии с желудочным эпителием, нейтрализации HCL с помощью уреазы, блокаде желудочной секреции специальным белком, подвижности и т.д.), но и за счет какого-то дефекта местной иммунной системы, врожденному или приобретенному под действием H.pylori, который не позволяет элиминировать бактерии естественным путем.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.