Видимо, когда адгезив вулканизуется или структурируется после образования контакта между ним и субстратом, образуются химические связи между молекулами адгезива и субстрата. Так, отмечено возникновение химических связей между металлами и клеями на основе аминов, отверждаемых эпоксидными смолами. Имеются сведения о возникновении химических связей между гидроксильными группами макромолекул целлюлозы и метилольными группами мочевиноформальдегидных и фенолформальдегидных смол [9].
Возникновение химических связей эффективно повышает адгезию, поэтому следует использовать подобные сочетания адгезивов и субстратов [9].
1.3.4 Электрическая теория адгезии
Из электрической теории адгезии следует, что субстрат, разделенный прослойкой адгезива, представляет собой конденсатор, разъединению обкладок которого препятствуют электрические силы. В темноте при отрыве пленки из каучука, нитроцеллюлозы и др. материалов от стекла, металла и других поверхностей можно наблюдать разряды, сопровождаемые свечением и легким треском. Исследования показали, что после отрыва поверхность каучука заряжается отрицательно, а поверхности стекла и металлаположительно. Единственным объяснением, согласующимся со всеми экспериментальными данными, является следующее. Поверхности на границе раздела фаз, образовавшиеся при отрыве пленки, наэлектризованы противоположными зарядами в силу разделения друг от друга обкладок молекулярного электрического двойного слоя [10].
Сцепление между адгезивом и подложкой образуется за счет силы электрического притяжения, работающей в двойном электрическом слое. Энергия отрыва (Ge) зависит от потенциала разряда (Ve) следующим образом:
![]() (4)
(4)
где h ̶ расстояние, на котором происходит разряд,м;
![]() ̶ электрическая постоянная,
̶ электрическая постоянная,![]() .
.
1.4 Смачивание
1.4.1 Краевой угол
Краевым углом (углом смачивания) обозначается угол, который образует капля жидкости на поверхности твердого вещества к данной поверхности. Размер краевого угла между жидкостью и твердым веществом зависит от взаимодействия между веществами на контактной поверхности. Смачивание является критерием адгезии для жидкостей [14].
На рисунке 1.3. Рассмотрим равновесие в системе, в которой капля жидкости помещена на твёрдую поверхность.
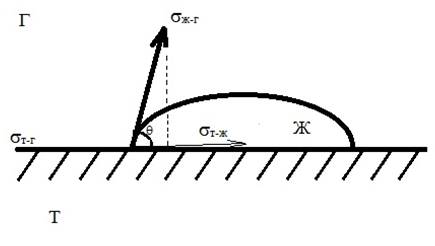
Рисунок 1.3 ̶ Теория смачивания [14]
Краевой угол q измеряется в сторону более полярной фазы (в данном случае в сторону воды). Обозначение sТ-Г показывает поверхностное натяжение между твердым телом и газовой фазой, sТ-Ж показывает поверхностное натяжение между твердым телом и жидкой фазой, а sЖ-Г показывает поверхностное натяжение между жидкой и газовой фазой [14].
Для измерения краевого угла необходимо провести касательную через 3 фазы (жидкость, газ, твердое тело). Угол между касательной и твердой фазой называют cos q, краевым углом смачивания. Угол q находится по таблице Брадиса [14].
Для состояния равновесия можно записать следующее условие:
![]() (5)
(5)
При проецировании на ось Х получим выражение:
![]() (6)
(6)
Из предыдущего выражения можно выделить cos q и получится уравнение Юнга.
![]() (7)
(7)
где q ̶ краевой угол смачивания, значение которого характеризует взаимодействие в системе Т-Г-Ж;
cos q ̶ смачивание.
Если sТ-Г > sТ-Ж, то 0 < cos q < 1, из чего следует, что угол q – острый (наступающий), а поверхность ̶ гидрофильная. Если s Т-Г > s Т-Ж, то 1 < cos q < 0, из чего следует, что угол q – тупой (отступающий), а поверхность ̶ гидрофобная [14].
В зависимости от угла q различают следующие типы реализации явления смачивания:
а) Смачивание 0°˂ q˂90° или 1˂ cos q˂0.
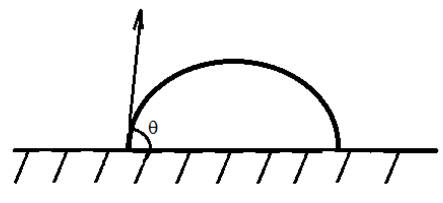
Рисунок 1.4 ̶ Схема смачивание от 0° до 90°
б) Полное смачивание (растекание) q ≈ 0° или cos q ≈ 1.
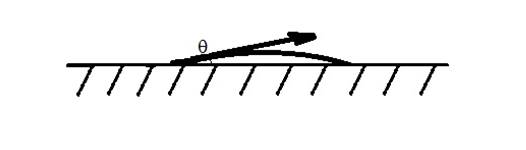
Рисунок 1.5 ̶ Схема полное смачивание ≈0°
в) Инверсия смачивания q = 90° или cos q= 0.
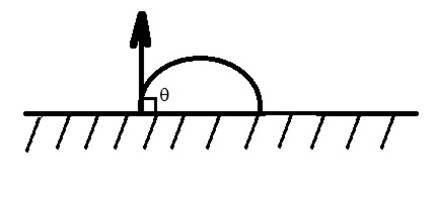
Рисунок 1.6 ̶ Схема инверсия смачивания г) Не смачивание или 0 ˂ cos q ˂ -1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.