Стереоизомеры (пространственные изомеры) – вещества, имеющие одинаковый состав и последовательность атомов, но различное расположение их в пространстве. s-Связь симметрична относительно оси, связывающей центры атомов, и при повороте фрагментов относительно друг друга энергия связи не меняется. Энергетически неравноценные формы молекул, переходящие друг в друга только за счет свободного вращения или изгиба связей, называются конформациями.
Конформация а (рис. 5.1.) называется заслоненной, конформация b – заторможенной. Возможно бесконечное количество промежуточных (скошенных) конформаций.
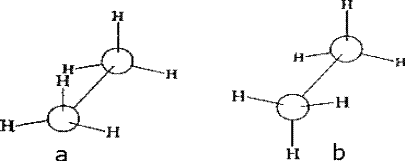
Рис. 5.1. Заслоненная (а) и заторможенная (b) конформации этана
Удобно изображать конформации с помощью проекций Ньюмена – взгляд вдоль связи, относительно которой происходит вращение. В заслоненной конформации атомы находятся ближе друг к другу, чем в заторможенной. Возникает сила, стремящаяся повернуть один фрагмент относительно другого – торсионное напряжение. Заторможенная конформация поэтому энергетически более выгодна, чем заслоненная. В этане энергетический барьер между конформациями составляет всего 3 ккал/моль (12 кДж/моль) (рис. 5.2).
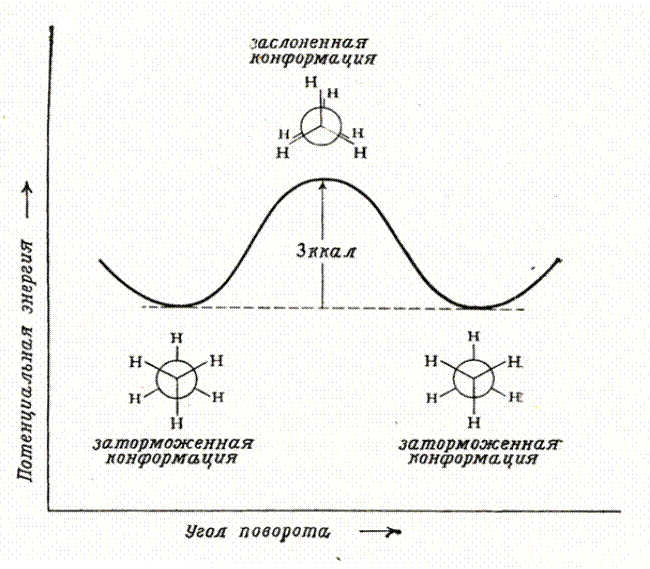
Рис. 5.2. Конформации этана и их относительные энергии
В соответствии с номенклатурой IUPAC для первых четырех алканов используют тривиальные названия, для последующих - греческие числительные с добавлением окончания –ан. Названия некоторых алканов нормального строения приведены в таблице. Нормальными называют алканы, имеющие неразветвленную углеродную цепь.
Названия некоторых алканов
|
Формула |
Название |
Формула |
Название |
|
CH4 |
Метан |
C8H18 |
Октан |
|
C2H6 |
Этан |
C9H20 |
Нонан |
|
C3H8 |
Пропан |
C10H22 |
Декан |
|
C4H10 |
Бутан |
C11H24 |
Ундекан |
|
C5H12 |
Пентан |
C12H26 |
Додекан |
|
C6H14 |
Гексан |
C16H34 |
Гексадекан |
|
C7H16 |
Гептан |
C20H42 |
Эйкозан |
Названия группировок, постоянно встречающихся как структурные единицы в органических молекулах, образуют исходя из названия исходного алкана. Так, остатки, условно образующиеся отщеплением от алкана одного атома водорода, вместо окончания –ан имеют окончание –ил. Например, CH3- называют метил, C2H5- этил и т.д. Весь массив таких остатков называют алкильными группами.
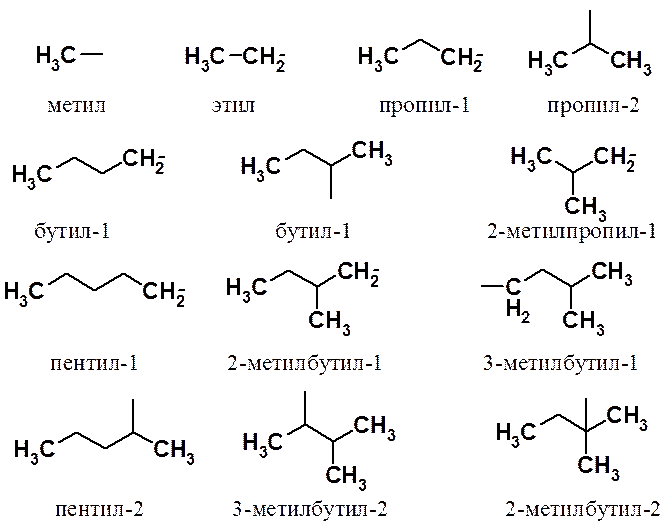
Основы номенклатурных правил IUPAC были изложены ранее.
Примеры названий алканов:
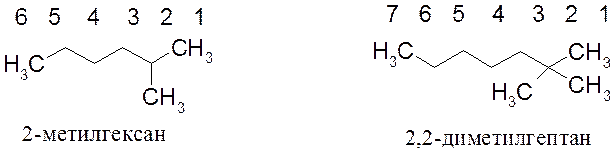
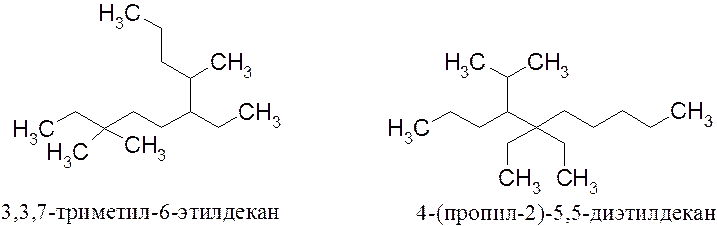
По номенклатуре IUPAC названия классов открытоцепных веществ имеют в основе названия алканов. Поэтому необходимо помнить названия, по крайней мере, первых десяти алканов и легко называть их производные. Зная названия алканов и алкильных групп легко понять, как образуются названия непредельных углеводородов, спиртов, галогенопроизводных и др.
Атомы углерода в алкане классифицируют, исходя из числа его углерод-углеродных связей.
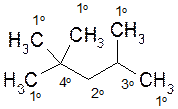
Первичный (1о) атом углерода связан с одним углеродным атомом, вторичный (2о) - с двумя, третичный (3о) – с тремя, а четвертичный (4о) - с четырьмя атомами углерода.
· Химические свойства алканов. Реакции свободнорадикального замещения (галогенирование, нитрование, сульфохлорирование и сульфоокисление). Понятие о цепных реакциях (стадии, квантовый выход). Селективность свободнорадикальных реакций и относительная стабильность свободных радикалов. Термические превращения алканов: изомеризация, крекинг. Окисление алканов. Применение алканов в органическом синтезе и в качестве моторного топлива. Детонационные и антидетонационные свойства топлива.
Старое название алканов - парафины. Этот термин происходит от латинского parum affinis (малое сродство) и говорит о низкой реакционной способности этого класса углеводородов. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они инертны по отношению к сильным окислителям и восстановителям.
Как было отмечено ранее, в алканах все атомы углерода связаны с четыремя другими атомами. Отсутствие в молекулах этого класса веществ кратных связей не позволяет рассчитывать на возможность протекания реакций присоединения.
Для соединений этого класса характерны реакции замещения. Характерным примером такого типа реакций являются хлорирование и бромирование алканов.
Рассмотрим хлорирование метана. Реакция протекает при нагревании или облучении смеси ультрафиолетовым светом. При этом атом хлора замещает атом водорода в метане, а второй атом хлора связывает атом водорода.
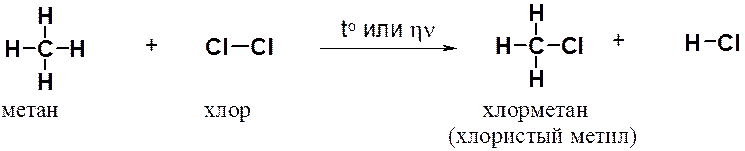
Образующийся в ходе реакции хлорметан в свою очередь вступает в реакцию с хлором с образованием дихлорметана (хлористого метилена). Далее реакция может продолжаться с образованием CHCl3 (хлороформа) и, в конце концов, -четыреххлористого углерода (CCl4).

В реакции может образоваться четыре продукта. Можно ли процесс остановить на требуемой стадии?
Реакция непосредственного галогенирования используется только для получения моно- или пер-галогеноалканов. Для проведения однозначной реакции используют большой избыток одного из реагентов. Для проведения реакции монохлорирования используют большой избыток метана. Основным продуктом реакции будет хлористый метил. Большое различие в температурах кипения между метаном и хлорметаном (> 130о С) позволяет легко отделить непрореагировавший метан и использовать его повторно. Аналогично проводят реакцию получения тетрахлорметана, используя большой избыток молекулярного хлора. В этом процессе разделение продукта и непрореагировавшего реагента еще проще, т.к. при комнатной температуре хлор находится в газообразном состоянии, а четыреххлористый углерод – жидкость.
Бром взаимодействует с метаном при высокой температуре или освещении ультрафиолетовым светом с образованием соответствующих производных (от моно- до тетрабромметана).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.