Рассмотрим простейший пример – образование молекулы водорода. Два атома водорода образуют молекулу Н2, отдавая по одному электрону, в результате каждому из атомов водорода принадлежит пара электронов, следовательно, их электронные оболочки завершены.
Н● + ●Н → Н—Н
При образовании ионной связи валентность атома легко предсказать, зная его положение в периодической системе элементов. Сложнее обстоит дело с ковалентной связью, поскольку она может образовываться разными способами.
Правило максимальной ковалентности:
· водород может быть только одноковалентен (не более электронов);
· элементы первого короткого периода (от Li до F) могут образовывать не более четырех ковалентных связей (не более 8 электронов);
· элементы от Na до Br (включительно) – не более шести ковалентных связей (не более 12 электронов);
· остальные не более 8 ковалентных связей (не более 16 электронов).
При образовании ковалентной связи (связей) перекрывание любого числа АО приводит к образованию такого же числа молекулярных орбиталей (МО). Отличие МО от АО в том, что они охватывают не одно ядро, а два (или большее число) ядер атомов.
При взаимодействии двух атомов одного элемента (энергия электронов одинакова) происходит образование двух локализованных МО, отличающихся по энергии.
Орбиталь, имеющая меньшую энергию, называется связывающей МО (МОсв). На ней располагается пара электронов ковалентной связи. Связь образуется за счет выигрыша в энергии. Энергия второй МО выше энергии АО. Электроны могут находиться на ней только в возбужденном состоянии. Эту МО называют разрыхляющей (МО*).
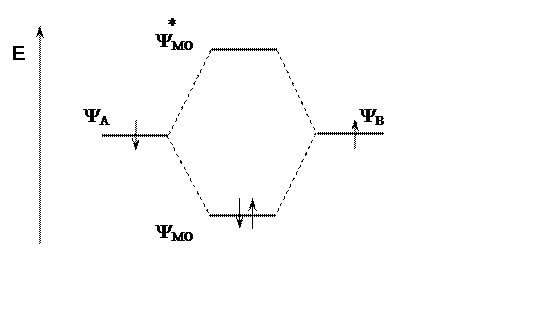
Рис. 2. Образование и энергии атомных и молекулярных орбиталей
У связывающей МО электронная плотность в пространстве между ядрами повышена, у разрыхляющей МО в пространстве между ядрами она отсутствует. Ковалентная связь – пара электронов находится на связывающей МО.
По такому же принципу образуются ковалентные связи между атомами разных элементов, а также в случае, когда один из атомов отдает пару электронов, а второй - свободную орбиталь.
В основном состоянии атом углерода имеет следующую электронную конфигурацию:
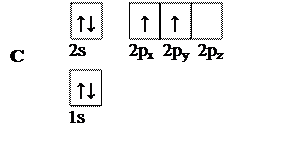 |
Рис. 3. Электронная конфигурация атома углерода в основном состоянии
Углерод в такой конфигурации не может образовывать четыре одинаковых ковалентных связи (см. лекцию 1).
Для объяснения четырехковалентности углерода в органических соединениях используют концепцию гибридизации (Л. Полинг, 1931 г.). Согласно этой концепции:
· один из электронов 2s-орбитали переходит на свободную 2р-орбиталь, образуя систему с четырьмя неспаренными электронами;
· 2s- и три 2p-орбитали смешиваются с образованием четырех эквивалентных sp3-гибридных орбиталей.

Рис. 4. sp3-Гибридные орбитали углерода
Используя концепцию гибридизации, построим простейшую органическую молекулу – метан. В результате перекрывания четырех гибридных sp3-орбиталей атома углерода и s-орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана. При такой геометрии все связи эквивалентны, а молекула обладает минимальной энергией.
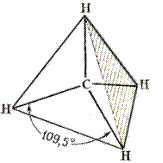
Рис. 5. Тетраэдрическая модель метана
Из рис. 5 отчетливо видно, что ковалентные связи, в отличие от ионных, обладают направленностью. Ковалентная связь образующаяся за счет перекрывания орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется s-связью (s – сигма). Она обладает круговой симметрией – при повороте связанных фрагментов относительно линии, связывающей центры атомов, энергия связи не меняется. Из s-связей построены насыщенные углеводороды и углеводородные фрагменты их функциональных производных. Длина С-Н связи 0,11 нм (1,1 Å), энергия – 417 кДж/моль (102 ккал/моль). Длина С-С связи 0,154 нм (1,54 Å), энергия – 347,5 кДж/моль (83 ккал/моль).
В этилене атомы углерода связаны между собой двойной связью. Углероды находятся в sp2-гибридизованном состоянии. Две 2p- и одна 2s-орбитали смешиваются с образованием трех одинаковых sp2-гибридных орбиталей. Формы sp2- и sp3-орбиталей одинаковы. В этом случае гибридные орбитали расположены в одной плоскости под углом 120о (рис. 6). Тригональное (плоскостное) расположение гибридных орбиталей наиболее энергетически выгодно. Каждый из углеродов использует две sp2-орбитали для образования двух s-связей С-Н и одну sp2-орбиталь для образования С-С s-связи.
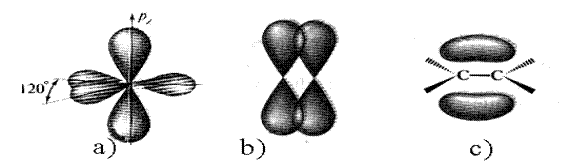
Рис. 6. sp2-Гибридизованный углерод (a), перекрывание 2p-орбиталей (b)
и молекула этилена (с)
Не участвующая в гибридизации 2р-орбиталь расположена перпендикулярно плоскости. Боковое перекрывание негибридизованной 2р-орбитали одного углеродного атома с соответствующей орбиталью другого углерода приводит к образованию p-связи. Эта связь состоит из двух частей: одно электронное облако расположено над, другое - под плоскостью, в которой лежат атомы.
Двойная С=С связь – комбинация s- и p-связей. Длина С=С связи 0,134 нм (1,34 Å), общая энергия – 607,1 кДж/моль (145 ккал/моль). Вычитая из общей энергии известную энергию одинарной s-связи можно получить энергию p-связи:
607,1 кдж/моль - 347,5 кдж/моль = 259,6 кдж/моль (62 ккал/моль)
p-Связь имеет меньшую энергию и, следовательно, менее прочна, чем сигма.
В простейшем соединении с тройной связью – ацетилене - оба углерода находятся в sp-гибридизованном состоянии. Эквивалентные гибридные орбитали расположены на одной прямой (линейное или дигональное расположение), проходящей через ядро углерода. При образовании тройной углерод-углеродной связи гибридные орбитали образуют две s-связи. Две негибридизованные р-орбитали за счет бокового перекрывания образуют две p-связи в двух взаимно перпендикулярных плоскостях (рис. 7).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.