Региоориентация присоединения легко объясняется исходя из предложенного выше механизма электрофильного присоединения. Первая стадия реакции – присоединение галогена - происходит таким образом, что образуется наиболее устойчивый карбокатион.
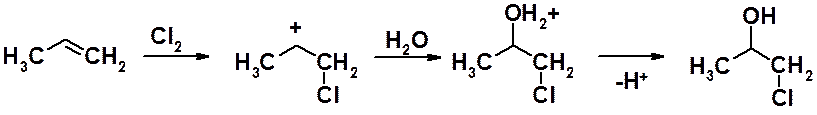
Иногда эту реакцию формально рассматривают как присоединение хлорноватистой или бромноватистой кислот к алкенам. Однако существует большое количество экспериментальных фактов, указывающих на то, что галогенгидрины образуются в результате взаимодействия алкенов с галогеном и водой.
Под термином «окисление алкенов» подразумевают реакции, в которых происходит разрыв только p- или p- и s-связей этиленового фрагмента. Более глубокое окисление, затрагивающее алкильные заместители в этом разделе не рассматривается.
В зависимости от строения алкена, природы окислителя и условий проведения реакции могут образовываться эпоксиды, 1,2-диолы, альдегиды, кетоны, карбоновые кислоты и углекислый газ. Некоторые реакции окисления могут быть использованы для определения положения двойной углерод-углеродной связи.
Эпоксисоединения (оксираны или органические оксиды) в лаборатории получают действием на алкены пероксикислот (реакция Прилежаева).
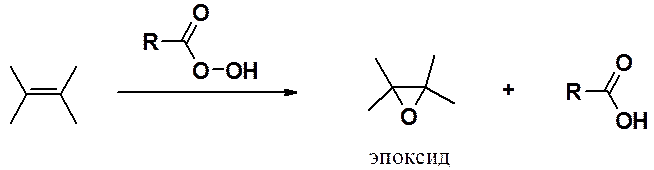
В промышленности получают в больших количествах эпоксиэтилен (этиленоксид) окислением этилена кислородом воздуха в присутствии серебряного катализатора.
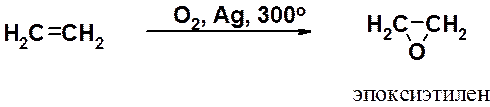
Сильные окислители (перманганат калия, дихромат калия, оксид хрома и др.) при нагревании легко расщепляют молекулу алкена по двойной связи. В зависимости от строения алкена результатом могут быть карбоновые кислоты и/или кетоны. Алкены с терминальной двойной связью выделяют также и СО2.
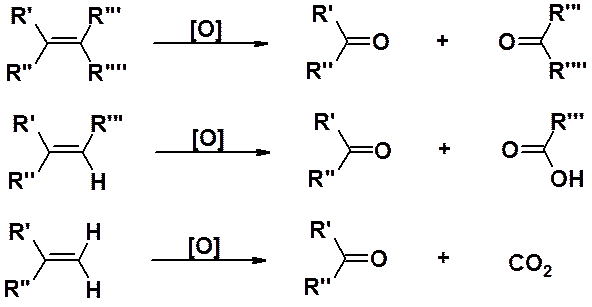
Алкены даже при пониженных температурах легко окисляются озоном с расщепление и p- и s-связи алкенового фрагмента. Озон пропускают через раствор алкена в инертном растворителе, после упаривания которого остается вязкое масло – озонид.
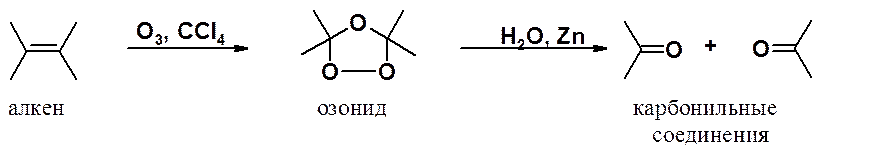 Обычно озониды не выделяют из-за
их высокой взрывоопасности. Их разлагают водой в присутствии восстанавливающего
реагента (цинковой пыли), чтобы предотвратить окисление альдегидов в карбоновые
кислоты. В результате образуются карбонильные соединения (альдегиды и кетоны),
в которых атомы кислорода связаны двойными связями с теми атомами углерода,
которые в исходном алкене были соединены двойной углерод-углеродной связью.
Обычно озониды не выделяют из-за
их высокой взрывоопасности. Их разлагают водой в присутствии восстанавливающего
реагента (цинковой пыли), чтобы предотвратить окисление альдегидов в карбоновые
кислоты. В результате образуются карбонильные соединения (альдегиды и кетоны),
в которых атомы кислорода связаны двойными связями с теми атомами углерода,
которые в исходном алкене были соединены двойной углерод-углеродной связью.
Карбонильные соединения легко могут быть идентифицированы физико-химическими методами, поэтому реакция Гарриеса часто используется для определения положения двойной связи в углеродной цепи. Ниже приведены результаты реакций озонолиза трех изомерных гептенов.
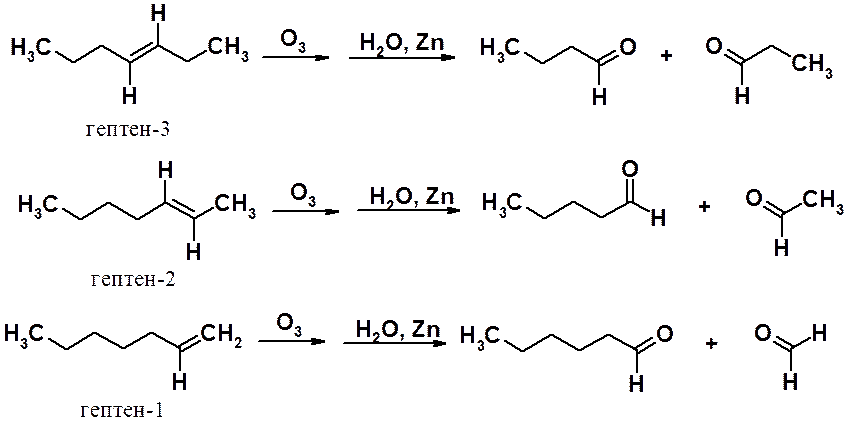
Строение продуктов озонолиза однозначно указывает на положение двойной углерод-углеродной связи в молекулах анализируемых алкенов. При озонолизе веществ со вторичными углеродами при кратной связи в результате образуются кетоны, с первичными – альдегиды, с концевой двойной связью – углекислый газ.
Русский химик Е.Е. Вагнер в 1898 г. открыл реакцию окисления алкенов до гликолей. Гликолями называют двухатомные спирты с вицинальным расположением гидроксильных групп. Окисление проходит при комнатной температуре в нейтральном или слабощелочном растворе перманганата калия.
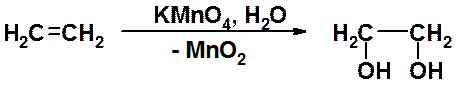
Реакция легко контролируется визуально, поскольку при образовании гликоля исчезает розовая окраска перманганата и образуется осадок оксида марганца. Поэтому реакция Вагнера может быть использована как качественная реакция на наличие в молекуле кратной связи. Гидроксилирование под действием перманганат-иона протекает стереоселективно и приводит к син-присоединению двух гидроксильных групп. Аналогично протекает гидроксилирование при окислении оксидом осмия OsO4.
Реакция Вагнера - наиболее простой метод получения 1,2-диолов и именно его следует применять при решении задач.
· Алкены. Реакции радикального замещения (аллильное галогенирование). Полимеризация олефинов и ее разновидности (цепная, ступенчатая, катионная, анионная, радикальная). Стереоспецифическая полимеризация. Полиэтилен, полипропилен.
Наличие алкильных групп в молекулах алкенов предполагает их способность участвовать в реакциях свободнорадикального замещения. Классической реакцией такого типа является галогенирование. Алканы реагируют с галогенами в газовой фазе при высокой температуре или освещении. Алкены присоединяют галогены в темноте, при низкой температуре и в жидкой фазе. Такие различия в условиях проведения реакции могут быть использованы для подбора условий, позволяющих проводить ионное присоединение или свободнорадикальное замещение.
При высокой температуре (> 300oС) пропилен вступает в реакцию с хлором с образованием аллилхлорида.
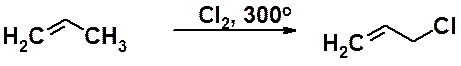
sp3-Гибридизованный атом углерода, находящийся по соседству с углеродом двойной связи, называется аллильным. Замещение водорода у аллильного атома – аллильное замещение. Эта реакция - общая для всех алкенов. Аллильное бромирование обычно приводят с использованием N-бромсукцинимида.
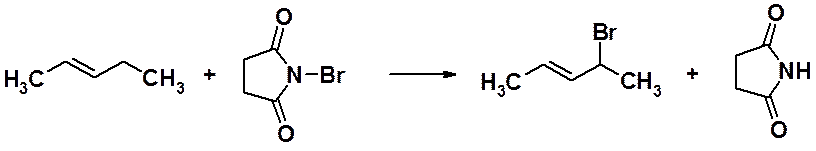
N-Бромсукцинимид создает постоянную низкую концентрацию атомов брома в реакционной смеси, что благоприятствует течению свободнорадикального замещения.
Следует отметить, что аллильный радикал легче образуется и обладает меньшей энергией, чем алкильные радикалы (причины таких свойств будут рассмотрены в других разделах). Как было показано в разделе алканы, свободнорадикальное замещение протекает через образование наиболее стабильного свободного радикала. Это объясняет региоселективность реакции аллильного замещения.
Одной из наиболее важных реакций органических соединений, содержащих двойные углерод-углеродные связи, является реакция полимеризации. В настоящее время высокомолекулярные соединения (ВМС, полимеры) проникли во все области человеческой деятельности.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.