Безграничное разнообразие органических соединений не позволяет привести полную их классификацию, поэтому выше приведен лишь ее фрагмент. Важнейшие функциональные производные органических веществ приведены в таблице 1.
Таблица 1
|
Функциональная группа |
Класс соединений |
Функциональная группа |
Класс соединений |
|
R-F, Cl, Br, I |
Галогенопроизводные |
R-C(O)NH2 |
Амиды |
|
R-OH, Ar-OH |
Спирты и фенолы |
R-NO |
Нитрозосоединения |
|
R-O-R’ |
Простые эфиры, оксираны |
R-NO2 |
Нитросоединения |
|
R-SH |
Тиолы (тиоспирты) |
R-NH2, RR’NH, RR’R’’N |
Амины |
|
R-S-R’ |
Сульфиды |
-N=N- |
Азосоединения |
|
R-CHO |
Альдегиды |
-NH-NH- |
Гидразосоединения |
|
R-C(O)-R’ |
Кетоны |
-N=N+ |
Диазосоединения (соли диазония) |
|
R-COOH |
Карбоновые кислоты |
R-SO2OH |
Сульфоновые кислоты |
|
R-C(O)OR’ |
Сложные эфиры |
-O-, -S-, -NH-, -N= в цикле |
Гетероциклические соединения |
Это система, описывающая строение и пространственное расположение атомов в молекуле.
Систематическое название – составленное в полном соответствии с принятыми номенклатурными правилами. В настоящее время наиболее распространенная и универсальная номенклатура IUPAC (International Union of Pure and Applied Chemistry).
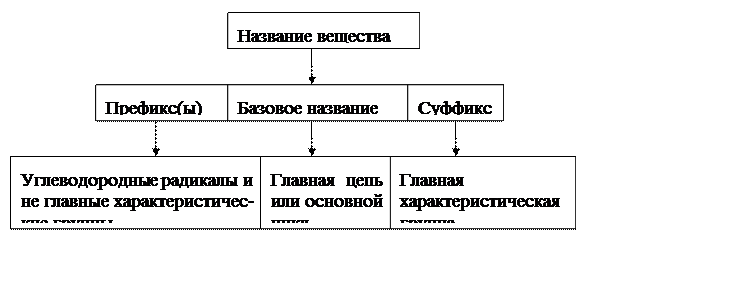
Базовое название – часть, на которой строится название в целом.
Заместитель – атом или функциональная группа, располагающаяся в исходном соединении вместо водорода.
Характеристическая группа – функциональная группа.
Главная группа – та, наличие которой указывает суффикс. Старшинство главных групп убывает в следующем ряду:
карбоновые кислоты > сульфоновые кислоты > сложные эфиры > амиды > нитрилы > альдегиды > кетоны > спирты и фенолы > тиолы > амины > имины
Локант – цифра или буква, которая указывает положение функциональной группы в молекуле.
Число одинаковых заместителей в молекуле указывают приставками ди-, три- и т.д. – умножающими префиксами.
Чтобы назвать вещество, необходимо выполнить следующую последовательность действий:
1. Определить главную характеристическую группу (ряд старшинства см. выше).
2. Определить базовую структуру – найти главную углеродную цепь или цикл. Базовая структура должна соответствовать следующим требованиям:
· включать максимальное число главных групп
· наибольшее количество кратных связей
· состоять из максимального числа углеродных атомов
· иметь наибольшее число заместителей
3. Назвать базовую структуру с учетом главной группы.
4. Определить и назвать заместители.
5. Пронумеровать атомы углерода базовой структуры так, чтобы главная группа получила наименьший номер. Если однозначный выбор сделать не удается, используют правило наименьших локантов. Базовую структуру нумеруют таким образом, чтобы заместители имели наименьшие номера. Из возможных последовательностей локантов правильная та, в которой раньше встретится меньшая цифра (1,3,6- меньше, чем 1,4,5-);
6. Объединить сделанное выше, создав полное название, перечисляя префиксы в алфавитном порядке.
Пример:

Номенклатура IUPAC конкретных классов органических веществ будет подробно рассмотрена в соответствующих разделах курса.
· Виды связей в органических соединениях. Волновое уравнение, волновая функция, атомные орбитали и их типы. Природа ковалентных связей. Типы молекулярных орбиталей.
· Электронная конфигурация и гибридизация углерода в органических соединениях. s- и p-Связи в органических соединениях, их характеристики: энергия, длина, полярность, поляризуемость.
Известно несколько видов химических связей: ионная, ковалентная, металлическая, водородная. Органические соединения образованы почти исключительно за счет ковалентных связей.
Движение электрона в зависимости от его энергии описывается уравнением Э. Шрёдингера (1926 г.) (1)
|
-h2 |
∂2ψ |
+ |
∂2ψ |
+ |
∂2ψ |
+ |
U ψ |
= |
E ψ |
(1) |
|||
|
8p2m |
∂x2 |
∂y2 |
∂z2 |
где:m – масса электрона; h – постоянная Планка; U – потенциальная энергия системы; Е – полная энергия системы; x,y,z – координаты; ψ – волновая функция.
Решение уравнения Шрёдингера дает области, в которых может находиться электрон во время своего движения в атоме. Квадрат модуля волновой функции |ψ|2Dt - вероятность нахождения электрона в объеме пространства. Объем, в котором вероятность нахождения электрона 95%, называется орбиталью.
Формы и расположение s-, p- и d-орбиталей известны из курса общей химии.
При образовании ковалентной связи верхние электронные оболочки атомов заполняются за счет обобществления электронных пар двумя (или несколькими) атомами.
Образование ковалентной связи при перекрывании атомной орбитали (АО) одного атома с АО другого. Чаще всего каждая орбиталь несет по одному электрону. Обобществленную электронную пару изображают линией, соединяющей связанные атомы. «Обобществленная» означает, что невозможно определить, какому из атомов принадлежит конкретный электрон. Пара электронов принадлежит одновременно каждому из атомов, образовавших связь.
A· + Б· ® А ·· Б или А—Б (структура Льюиса)
Другой способ образования ковалентной связи: один атом предоставляет АО с парой электронов, другой атом – свободную (вакантную) АО.
А·· + Б ® А—Б
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.