Важно: интермедиаты во многих случаях могут быть зарегистрированы физическими методами и, следовательно, их строение известно. Строение же переходного состояния неизвестно никогда.
Зная строение интермедиата мы в дальнейшем сможем делать заключение о том, какие структурные элементы могут его стабилизировать, а какие дестабилизировать и переносить это заключение на энергию переходного состояния.
· Равновесные реакции, константа равновесия, кинетический и термодинамический контроль. Механизм реакции и пути его установления. Принцип микроскопической обратимости, постулат Хэммонда.
· Кислоты и основания в органической химии (теории Бренстеда-Лоури и Льюиса). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотности (рКа), константа основности (рКb). Влияние заместителей на кислотность и основность органических соединений.
Особенность многих органических реакций состоит в том, что они равновесные.
aA + bB = dD + fF
Скорость прямой реакции: Vпр = KпрCAaCBb
Скорость обратной реакции: Vоб = KобCDdCFf
Когда скорости прямой и обратной реакции равны, наступает равновесие:
Vпр = Vоб
KпрCAaCBb = KобCDdCFf
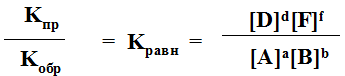
Кроме того, константу равновесия можно выразить через свободную энергию:
DG = -RTlnKравн
Важно: при наступлении состояния равновесия реакции не прекращаются. Одновременно протекают прямая и обратная реакция, но из-за постоянства концентраций исходных веществ и продуктов, кажется, что все процессы остановились. Просто скорости прямой и обратной реакции равны!
Если Vпр > Vобр, то в равновесном состоянии концентрации продуктов будут выше концентраций исходных веществ. Равновесие сдвинуто вправо. При Vпр < Vобр равновесие смещено влево, в сторону исходных веществ. Если в первом случае не удается выделить исходные соединения, считают, что реакция полностью прошла. Во втором случае, если не удается обнаружить продукты, реакция не идет.
В ряде случаев в результате протекания параллельных реакций в реакционной массе могут образовываться два продукта (C и D), один из которых превращается в другой либо непосредственно (по реакции 3) (рис 4.1а), либо в результате обратимости первой реакции (рис. 4.1б). Какой из продуктов является основным, очень часто зависит от температурных условий проведения превращения.
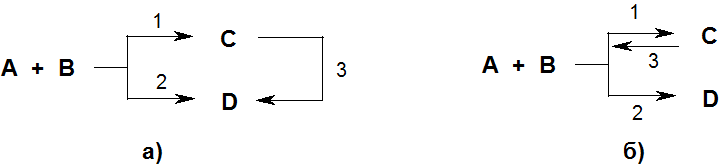
Рис. 4.1. Схемы конкурентных реакций
Энергетическая диаграмма процессов, изображенных на рис. 4.1а, показывает, что образование продукта С происходит быстрее, т.к. ЕаС этой реакции заметно меньше, чем ЕаD (рис. 4.2). При низкой температуре, когда энергия реагирующих молекул невелика, основное направление реакции – образование соединения С. Этот процесс контролируется скоростью и называется кинетически контролируемой реакцией, а соединение С – продуктом кинетического контроля.
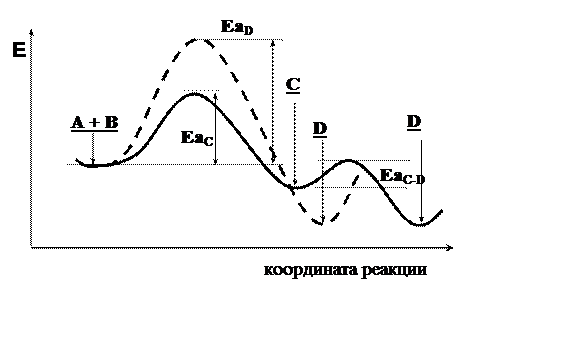 |
Рис. 4.2. Кинетический и термодинамический контроль
(последовательное превращение)
Образование соединения D требует большей энергии, поэтому при низкой температуре оно – побочный продукт. Однако продукт D термодинамически более устойчив, чем С. Поэтому с ростом температуры проведения реакции, когда большее число молекул способно перебраться через высокий энергетический барьер, в реакционной массе наблюдается преобладание продукта D. Процесс образования соединения D контролируется энергетическими факторами и называется термодинамически контролируемой реакцией. Соединение D – продукт термодинамического контроля.
Соединение С образуется быстро. Его стабильность относительно низка, а энергия активации превращения С в D (ЕаС-D) невелика. При проведении реакции при повышенной температуре (т.е. в условиях термодинамического контроля) происходит превращение соединения С в более энергетически выгодный продукт Д.
На рис. 4.3 показаны энергетические профили реакций кинетического (образование С) и термодинамического (образование D) контроля для обратимых превращений.. Причины особенностей протекания реакций аналогичны изложенным выше.
 |
Рис. 4.3. Кинетический и термодинамический контроль (обратимое превращение)
Отличается только превращение продукта кинетического контроля С в продукт термодинамического контроля D. При повышенной температуре происходит превращение соединения С в исходные вещества A и B. Процесс протекает быстро, т.к. энергия активации этого процесса незначительна. Превращение D в исходные продукты протекает значительно труднее, и он накапливается в реакционной смеси.
Образование продуктов кинетического и термодинамического контроля – классический случай протекания органических реакций. Конкретные реакции будут рассмотрены в соответствующих разделах (см., например, химические свойства 1,3-алкадиенов, лекция № 15).
В органической химии используются две теории кислот и оснований:
· теория Брёнстеда-Лоури;
· теория Льюиса.
В основе теории - перенос протона (Н+). Согласно Бренстеду-Лоури кислоты – вещества, способные выступать в качестве донора протона (т.е. его отдавать); основания – вещества, способные быть акцепторами протона (т.е. его присоединять).
Уравнение кислотно-основного взаимодействия по Брёнстеду-Лоури:

Для проявления кислотных свойств органических соединений связь водород-элемент должна быть полярной или поляризованной. Многие вещества содержат связи О-Н, N-H, S-H. В ряде случаев кислотные свойства могут проявлять и С-Н фрагменты. В зависимости от элемента, отдающего протон, органические кислоты классифицируют на ОН-, SH-, NH- и СН-кислоты. Кислотные свойства могут проявлять нейтральные молекулы или катионы.
Основания же должны иметь или неподеленную пару электронов у атома, присоединяющего протон, или отрицательный заряд. В некоторых случаях основные свойства могут проявлять соединения с p-связями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.