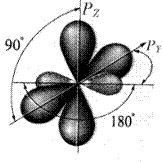
Рис. 7. sp-Гибридизованный атом углерода
Таким образом, тройная связь построена из двух p- и одной s-связи. Ее энергия - 829 кДж/моль (198 ккал/моль). Поскольку энергия С=С связи известна, энергия третьей связи может быть определена – 222 кДж/моль (43 ккал/моль). Длина тройной связи – 0,12 нм (1,2 Å).
Чем связь короче, тем она прочнее.
Следует помнить, что гибридизация – это математическая обработка параметров орбиталей в соответствии с принципами квантовой механики, позволяющая сохранить концепцию ковалентных связей с помощью пар электронов. Гибридизация не является экспериментально доказанной реальностью.
Как показано выше, ковалентная связь образуется за счет обобществления пары электронов. Ядра атомов, связанных ковалентной связью, удерживаются друг около друга за счет общей электронной пары. Чаще всего распределение электронной плотности не равномерно. У одного атома она выше, чем у другого. Один конец связи богаче электронами (более отрицательный), другой – беднее (более положительный). Такая связь называется полярной. Ковалентная связь полярна, когда она образована атомами по-разному притягивающими электроны, т.е. имеющими разную электроотрицательность. Связи, образованные атомами одного элемента, например С-С, – неполярны. Также неполярны и связи С-Н.

Рис. 8. Неполярные (а) и полярные (б) связи
Знаки d+ и d- (дельта-плюс и дельта-минус)показывают, в каком направлении происходит сдвиг электронной плотности. Сам знак дельта означает частичный (не полный) заряд.
В некоторых случаях электроны неполярной связи могут быть распределены неравномерно под действием окружения. Такая связь называется поляризованной (рис. 9). Электронная плотность связей углерод-хлор сдвинута в сторону более электроотрицательного атома - галогена. В результате атом углерода группы -CCl3 сильно позитивирован. Электроны s-связи С-С притягиваются к углероду, имеющему недостаток электронной плотности (показано изогнутой стрелкой). Это и есть поляризация связи.
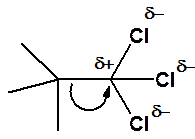
Рис. 9. Поляризованная углерод-углеродная связь
Понимание того, какие связи являются неполярными, какие полярными или поляризованными чрезвычайно важно для всего курса органической химии.
· Классификация органических реакций по характеру превращения, по способу разрыва связи в исходной молекуле. Электрофильные, нуклеофильные и радикальные реагенты и реакции.
· Понятие о промежуточных частицах (радикалы, карбокатионы, карбанионы) и их строение. Электронные эффекты заместителей (индуктивный, мезомерный), их влияние на устойчивость промежуточных частиц. Резонансные структуры.
· Факторы, определяющие возможность протекания реакций. Энергетическая кривая. Энтропийный и энтальпийный факторы, потенциал Гиббса, энергия активации, переходное состояние. Равновесные реакции, константа равновесия, кинетический и термодинамический контроль. Механизм реакции и пути его установления. Принцип микроскопической обратимости, постулат Хэммонда.
Бескрайнее число органических реакций может быть сведено к нескольким типам.
Реакции замещения:
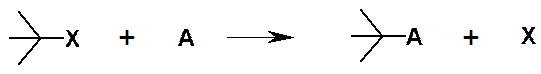
Обозначают S (от англ. substitution). Х – Уходящая группа.
Реакции присоединения:
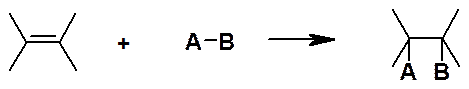
Обозначают A (от англ. addition).
Реакции отщепления (элиминирования):
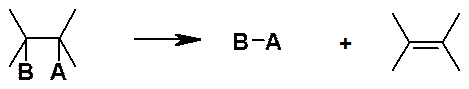
Обозначают E (от англ. elimination).
Перегруппировки:
![]()
Реакции окисления и восстановления:
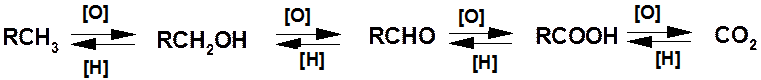
В органической химии под окислением понимают процесс удаления водорода с образованием новой связи между углеродом и атомом с большей электроотрицательностью, чем водород, или кратной связи. Восстановление - обратный окислению процесс.
Перициклические (согласованные) реакции: циклоприсоединение, электроциклические реакции, сигматропные перегруппировки.
Гомолитический разрыв связи:
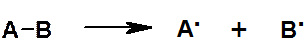
Частицы, несущие неспаренный электрон, называются свободными радикалами (R.). Необходимо отличать термины:
· радикал – органический остаток (фрагмент);
· свободный радикал – частица с неспаренным электроном.
Гетеролитический разрыв связи:
![]()
Атом или группа атомов, имеющие избыток электронной плотности и способные выступать в роли донора электронной пары при образовании ковалентной связи, называются нуклеофилами (Nu). В роли нуклеофилов могут выступать как анионы, так и нейтральные молекулы. В переводе на русский язык нуклеофил – «любящий ядро», т.е. положительный заряд.
Частица или фрагмент молекулы, имеющие недостаток электронной плотности или свободную орбиталь и способные принимать пару электронов с образованием ковалентной связи, называются электрофилами (E). Ими могут быть как катионы, так и нейтральные молекулы. Электрофил – «любящий электроны», т.е. отрицательный заряд.
Объединим классификации.
Реакции замещения могут происходить под действием свободных радикалов, электрофилов и нуклеофилов. Пример реакции нуклеофильного замещения:
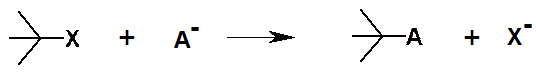
Аналогично реакции присоединения, элиминирования и перегруппировки могут протекать под действием нуклеофилов, электрофилов и свободных радикалов.
Основным критерием возможности протекания химической реакции является термодинамический аспект процесса. Термодинамика процесса описывается следующим уравнением:
DG = DH ¾ TDS
где DG - изменение свободной энергии в ходе реакции, DH - изменение энтальпии, DS - изменение энтропии.
Любая система (молекула или группа молекул) стремится находиться в наиболее устойчивом состоянии, т.е. стремится к минимуму внутренней энергии. В этом случае молекула наиболее термодинамически и химически стабильна. Поэтому реакция протекает в том случае, когда она сопровождается уменьшением свободной энергии. Величина DG является критерием возможности протекания химической реакции. Если DG меньше 0 – реакция возможна (но не означает, что она идет), если DG больше 0 – протекание реакции невозможно.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.